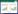文章信息
- 许凤, 崔艳慧, 梁鑫, 刘吉成, 宋波, 洪越, 李莉
- XU Feng, CUI Yanhui, LIANG Xin, LIU Jicheng, SONG Bo, HONG Yue, LI Li
- 薄层色谱与表面增强拉曼光谱法鉴别一次性纸杯中荧光增白剂
- Determination of fluorescent whitening agents in disposable paper cups by thin layer chromatography and surface enhanced Raman spectroscopy
- 中国测试, 2024, 50(6): 79-86
- CHINA MEASUREMENT & TEST, 2024, 50(6): 79-86
- http://dx.doi.org/10.11857/j.issn.1674-5124.2022050178
-
文章历史
- 收稿日期: 2022-05-28
- 收到修改稿日期: 2022-08-19
2. 北大荒集团九三医院,黑龙江 黑河 161441
2. Jiusan Hospital of Beidahuang group, Heihe 161441, China
荧光增白剂(FWAs)是一种荧光染料,能吸收波长为300~400 nm的紫外光,再激发出波长420~480 nm的蓝色或蓝紫色荧光。食品包装材料中常见荧光增白剂包括香豆素类、苯丙恶唑类、萘二甲酰亚胺类、吡唑啉类、三嗪氨基二苯乙烯类,这些荧光增白剂在人体内不易被分解,其毒性累积在肝脏或其他重要器官,成为潜在的致癌因素,可能会诱发癌变[1]。研究表明,某些FWAs会引起人体过敏反应及光致诱变效应[2]。应用于纸质食品包装材料中的FWAs主要为双三嗪氨基二苯乙烯型(DSD-FWAs)[3]。
目前国内外关于FWAs的检测方法主要有[4-7]荧光分光光度法、紫外分光光度法、红外光谱法、高效液相色谱法、薄层色谱法-质谱联用法与高效液相色谱法-质谱联用法等,但是上述几种方法分别存在误差大、灵敏度低、实验条件复杂、检验成本高等问题。薄层色谱(TLC)法作为经典的微量物质分离方法,具有操作简单、成本低、需样量少、操作速度快等优点,但易出现假阳性结果。拉曼光谱是分子在一定波长光照下因非弹性碰撞产生的散射光谱,可反映分子结构的指纹信息,具有较强的专属性[8-9],但灵敏度较低;表面增强拉曼光谱(SERS)能有效提高拉曼光谱灵敏度,且能保留待测分子的指纹信息,但容易受到其他背景物质干扰。本实验采用TLC作为待测物质的初步分离技术、以SERS作为检测手段[10-11],二者联用可形成优势互补,能有效提高被测物质分析的灵敏度与专属性,实现分离与定性的目的,可为荧光增白剂检测提供更多的备选方法。
1 实验部分 1.1 材料与试剂硝酸银(分析纯,上海国药集团化学试剂有限公司);柠檬酸钠、氯金酸和吡啶(分析纯,上海阿拉丁生化科技股份有限公司);氯化钠(分析纯,天津市福晨化学试剂厂);荧光增白剂71(C.I.71)、荧光增白剂85(C.I.85)、荧光增白剂90(C.I.90)、荧光增白剂113(C.I.113)4种荧光增白剂对照品(纯度99%,Stanford Chemicals Company);实验用水均为超纯水。
1.2 仪器与设备DXRxi显微拉曼成像光谱仪(Thermo Fisher Scientific,USA,激发波长780 nm、542 nm);T6新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司);Nano-ZS90纳米粒度仪(Malvern Instruments Ltd,UK);HITACHI扫描电子显微镜(Transmission Electron Microscope HT7700);XS105 DualRange 分析天平(精密度:0.01 mg,METTLER TOLEDO,Switzerland);Midea微波炉;KQ-250B数控超声波清洗器(昆山市超声仪器有限公司);硅胶GF254铝制薄层板(德国默克公司);定量毛细管(4 μL,天津思利达色谱公司)。
1.3 实验方法贵金属银、金及其混合物是目前最常用的拉曼光谱表面增强剂,其纳米级金属溶胶在SERS技术中得到了广泛的应用。本文参照现有文献,分别采用传统加热法与微波法制备银、金、银包金、金包银4种金属纳米溶胶。
1.3.1 传统加热法制备银纳米溶胶称取45 mg硝酸银溶于250 mL超纯水中,取207 mL硝酸银溶液微波加热至沸腾后加入1%柠檬酸钠4.1 mL,混合均匀,置于磁力电加热板上,边搅拌边加热,保持沸腾1 h后自然冷却,得到灰绿色银溶胶。
1.3.2 微波加热法制备金属纳米粒子溶胶1)银纳米粒子溶胶的制备 先用分析天平称取56 mg硝酸银溶于150 mL超纯水中,备用。再称取0.2 g柠檬酸钠溶于20 mL超纯水(1%),备用。
取硝酸银溶液100 mL于250 mL玻璃瓶中,放入微波炉中加热至沸腾后取出,一次性加入1%柠檬酸钠2.6 mL,混合均匀后继续加热2 min,冷却,得到灰绿色银溶胶。
2)金纳米粒子溶胶的制备 用分析天平称取氯金酸50 mg溶于50 mL超纯水中,放入微波炉中加热至沸腾后取出,一次性加入1%柠檬酸钠1 mL,混合均匀后继续加热2 min,冷却。反应过程中溶液初显淡蓝色,逐渐变为深蓝色,最后得到玫瑰红色金溶胶。
3)金包银纳米粒子溶胶的制备 取20 mL制备好的金溶胶,用水稀释至80 mL放入微波炉中加热至沸腾后取出,加入硝酸银溶液20 mL,再加入1%柠檬酸钠0.5 mL,混合均匀后继续加热2 min,冷却,得到蓝灰色金包银溶胶。
4)银包金纳米粒子溶胶的制备 取20 mL制备好的银溶胶,用水稀释至80 mL,放入微波炉中加热至沸腾后取出,加入氯金酸溶液(0.1%)20 mL,再加入1%柠檬酸钠2 mL,混合均匀后继续加热2 min,冷却,得到浅玫瑰色银包金溶胶。
1.3.3 TLC-SERS溶液的制备对照品溶液的制备:分别取C.I.71、C.I.85、C.I.90、C.I.113对照品适量,精密称定,分别加入40%乙腈溶液适量,振摇、溶解,制成2 μg/mL的对照品溶液,备用。
样品溶液的制备[12]:将一次性纸杯样品展开成平板状,逐份通过碎纸机将样品粉碎成纸屑,将纸屑全部转移至高速粉碎机中,盖紧粉碎机盖子,以10000 r/min的转速粉碎6次,每次约15秒,将纸屑粉碎成纤维状,每次粉碎后需使用勺子将纸屑碎末搅匀,用干净的聚乙烯塑料袋盛放纤维状纸屑,外面再套上一个密实袋,编号,室温下于黑暗处保存备用。称取0.500 g粉碎均匀的样品纸屑至50 mL聚乙烯塑料离心管中,拉紧实验室窗帘并关闭实验室日光灯,使实验环境处于避光状态(要求照度小于20 lx)。加入40%乙腈溶液25 mL,50 ℃水浴下超声提取35 min,提取结束后,以4000 r/min的转速离心5 min。转移上清液至旋转蒸发仪中,再于纸屑中分两次加入40%乙腈溶液12.5 mL,同上述提取步骤提取10 min,重复两次,合并前后3次的上清液,在50 ℃水浴中旋转蒸发近干,再用40%乙腈定溶至0.5 mL,于阴暗处保存,备用。
1.3.4 TLC-SERS法的建立分别吸取10 μL对照品溶液与样品溶液,点在同一块GF254硅胶板上,展开剂为甲醇-乙酸乙酯-冰醋酸-水(1∶3∶0.5∶0.5, V/V/V/V),饱和10 min后,展开,取出晾干,置于365 nm紫外灯下检视并定位,用乙醇原位富集,提高目标物分子密度。分别在对照品富集斑点与Rf值相同的样品富集斑点上滴加4 μL银溶胶,再分别加入2粒氯化钠,使银溶胶胶粒聚集以增大其浓度,于原位采集对照品与样品的拉曼信号,二者的SERS应一致。
拉曼光谱仪工作条件:激光光源波长780 nm,显微镜倍数10倍,图像像素5.0 μm,扫描范围0~3300 cm–1,50 μm共聚焦针孔光阑,扫描方式为区域点扫,激光功率24.0 mW,曝光时间0.05000 s,扫描次数为30。
2 结果与讨论 2.1 贵金属溶胶钠米粒子的表征分别采用紫外-可见分光光度计、纳米粒度仪和扫描电镜仪对自制的5种金属溶胶的粒径、分布等情况进行了表征,并筛选与确定后续用金属溶胶的制备方法与种类。
2.1.1 紫外光谱法溶胶金属粒子表面等离子体共振在UV-Vis光区产生的吸收光谱的峰形、强度与该纳米粒子的浓度、形状、粒径及粒径分布密切相关。通常半峰宽仅与粒径分布有关,半峰宽窄则意味着粒径分布较小;最大吸收波长位置可对粒径种类进行初步表征,当粒径种类固定时,波长越大,粒径越大[13];峰的数目能反映纳米粒子的形状,通常球形粒子只有一个吸收峰[13],且单个吸收峰的出现表明胶体的粒径相对均匀。
首先,对已制备的5种溶胶进行适当稀释,再分别在一定波长范围内进行吸收光谱扫描,结果见图1。

|
| 图 1 不同种金属溶胶紫外-可见光谱图 |
1)从图1“图谱a、b”可见,传统法和微波法制备的银溶胶只有一个吸收峰,最大吸收波长均为434 nm,说明二者粒径基本一致,且为球形;但二者的半峰宽分别为160 nm与147 nm,说明微波法较传统法的半峰宽窄13 nm,故微波法粒径分布较小,分子密度大,粒子均匀性更好。
2)从图1“图谱b、c”可见,由等离子体激发共振引起的银溶胶和金溶胶的最大吸收波长分别为434 nm和525 nm,二者相差为-91 nm,是因为二者来自不同物质所致,但均为单峰,说明银、金单质均呈球型,粒子分布均较均匀。
3)从图1“图谱d、e”可见,微波银包金、微波金包银溶胶的最大吸收波长分别为545 nm、518 nm,因银包金溶胶受金的影响,故较银溶胶的最大吸收波长发生了红移,其粒径也将随之增大;同理,因金包银溶胶受银的影响,故在金溶胶最大吸收波长基础上进一步红移,其粒径也将较金溶胶的大。此外,银包金、金包银溶胶的吸收峰均不明显,吸收范围变得更广泛,其半峰宽很大,故粒径分布较大,粒子均匀性差,故与银溶胶和金溶胶相比,两种混合溶胶均不适宜作为本文的SERS基底。
2.1.2 电镜测定法溶胶粒径的大小是SERS增强效果的主要因素之一。纳米粒子颗粒的直径介于10~150 nm之间。当金属纳米粒子的粒径小于40 nm时,随着粒径的增大SERS的增强信号会越来越强;金属纳米粒子的粒径大于40 nm时,随着粒径的增大SERS的增强信号会越来越弱[14]。本文采用透射电子显微镜(TEM)分别在100.0 kV加速电压下检测上述5种溶胶的粒径及分布状态,结果见图2。

|
| 图 2 不同类型金属溶胶的透射电子显微镜照片 |
1)从图2“a、b”可见采用传统法与微波法制备的银溶胶颗粒分布有明显差异,前者密度较低,且以棒状及长方形为主;后者密度较大,呈不规则形的较多,偶见球形。
2)从图2“b、c”可见,金溶胶和银溶胶粒径差异较大,分别为20~30 nm和38~80 nm,金溶胶不仅粒径相对小、且分布更均一,无棒状等不规则形状的颗粒。
3)从图2“d”可见,对于银包金溶胶来说,可见到明显长链状凝聚的形成。银包金和金包银粒子的沉积机制类似,银包金的胶体只是由于银粒子的粒径较大而导致团聚现象比金包银粒子严重。
4)从图2“e”可见,对于金包银溶胶来说,颗粒形成了核壳结构,粒径较金溶胶的粒径大。因为金比银对电子的散射更有效,因而在电镜中较暗的部分是金纳米颗粒、较亮的部分是银纳米颗粒。在本文的实验条件下,加入到银溶胶中的Au3+部分吸附在Ag纳米粒子表面,再还原生长形成金壳,并聚集在银表面。
综上所述,银溶胶与金溶胶比较,颗粒不规则、分布不均匀,可能是因为单质银在水及空气中不稳定,产生氧化银等杂质所致。但是,金溶胶和银溶胶粒径分别为20~30 nm和38~80 nm,从图2(b)可见,银溶胶中含有部分低于40 nm的颗粒,这部分颗粒将具有较强的SERS增强效果,是银溶胶发挥拉曼增强作用的核心因素。故采用银溶胶作为SERS增强基底可能是较好的选择,但仍需采用下列实验进一步证实与论证。
2.1.3 电势与粒径测定法通过纳米粒度仪可分别测定溶胶的电势电位与粒径,用以反应溶胶的质量信息。本文对上述5种溶胶测定结果见图3。
|
| 图 3 不同溶胶电势图与粒径图 |
Zeta电势绝对值大于30 mV时,金属纳米粒子稳定,纳米颗粒间不产生团聚现象,不同纳米粒子的电势在25~45 mV之间[13]。
由图3(a)可见,金纳米粒子的Zeta电势最低,为24.1 mV。说明5种溶胶中,微波法制备的金溶胶的稳定性最差;由图3(b)可见,微波法制备的金包银、银包金溶胶平均粒径分别为125.5 nm与147.8 nm,均大于40 nm,故银包金SERS增强效果最差。微波法制备的金溶胶平均粒径为12.49 nm、银溶胶平均粒径为24.38 nm,两者平均粒径均处于40 nm以下,但后者较前者大,故SERS增强效果后者更佳,此结果与“2.1.2”判定结果一致。
由图3(a)可见,传统法与微波法制备的银溶胶电势电位无显著差异,分别为35.0 mV与35.7 mV;两种溶胶中单质银平均粒径差异也不明显,分别为25.3 nm与24.3 nm。因微波法较传统法操作简便、省时,且加热方式均匀、快速,使分子碰撞几率更均匀、柠檬酸钠分解速度相对快,单质银能迅速得到过量还原剂的保护,故纳米粒子的密度可能更大、粒径可能更均匀;而传统法采用电板加热时,因热传递不均匀,使分子碰撞几率相对不稳定、柠檬酸钠分解速度相对较慢,单质银粒径可能不均匀,所以微波法较传统法作为银溶胶的制备方法具有一定的优势。
综上所述,本文优选微波法制备的银溶胶作为后续实验的SERS增强基底,它具有操作简便快捷、稳定性较高、平均粒径适中、分布均匀等优点。
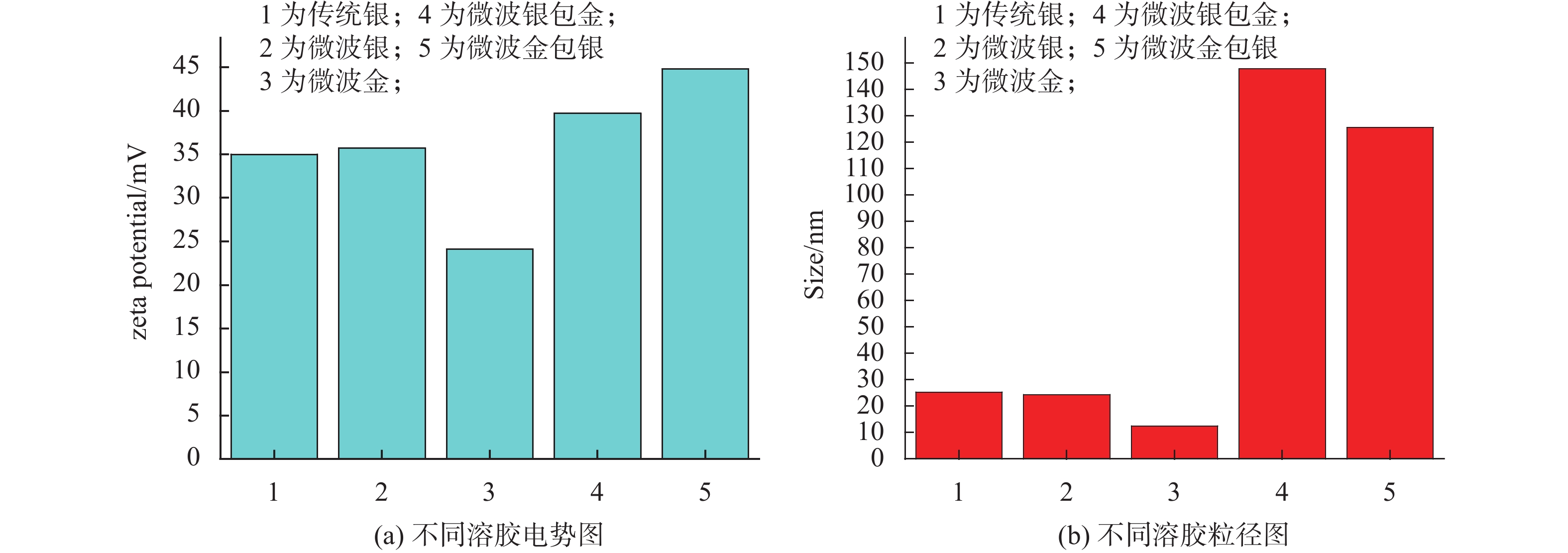
2.2 银溶胶拉曼增强效果考察由“2.1.3”可知金溶胶稳定性最差,且由于金溶胶粒子背景很强,故不适于作为本实验SERS增强基底,不再考虑其增强效果。吡啶为常用的SERS探针,现以780 nm为激发光波长,通过比较上述4种微波银、传统银、微波银包金、微波金包银等含银溶胶对吡啶拉曼光谱的增强效果,进一步验证微波法制备银溶胶的优势,见图4与表1。以1036 cm–1峰为内标峰,可以计算出各种金属溶胶的增强因子。计算公式为
|
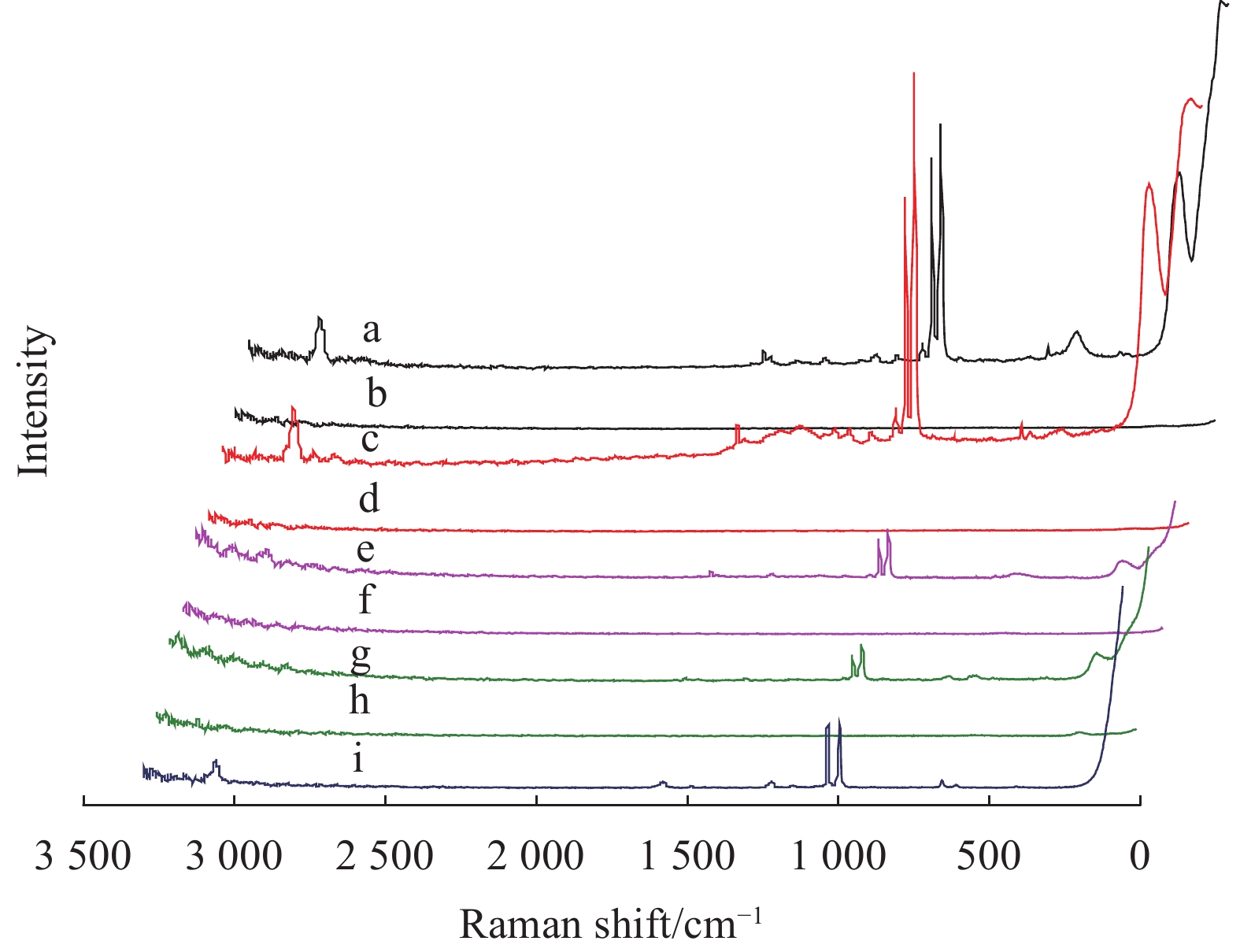
| 图 4 吡啶在不同金属溶胶增强下的SERS图谱 a.传统银;b.传统银背景;c.微波银;d.微波银背景;e.微波银包金;f.微波银包金背景;g.微波金包银;h.微波金包银背景;i.吡啶。 |
Ef=(ISERS×NNRS)/(NSERS×INRS),其中ISERS和INRS分别为样品的SERS强度和正常拉曼光谱强度,NSERS和NNRS分别为表面样品中和正常样品中参与散射的分子数,4种含银溶胶增强因子见表1,可见金属溶胶的增强因子由强至弱顺序是:微波银溶胶>传统银溶胶>微波银包金溶胶>微波金包银溶胶。微波法和传统法制备的银纳米粒子均具有较好的拉曼散射增强效果,但前者增强因子略高于后者,故本实验选用微波法制备的银溶胶作为SERS增强基底。另外由图4可看到a、c与e、g的SERS图谱右端250 cm–1附近谱峰响应值差异较明显,这可能因为在电磁场增强和化学增强的共同作用下,Ag与吡啶氮形成的增强作用强于Au与吡啶氮形成的增强作用,故传统银溶胶和微波银溶胶中的Ag与吡啶氮作用强,使其拉曼信号增强较明显;而在银包金溶胶和金包银溶胶中,Ag受Au的影响,使Ag与吡啶氮作用减弱致使拉曼信号减弱。
2.3 TLC-SERS展开结果采用甲醇-乙酸乙酯-冰醋酸-水(1∶3∶0.5∶0.5, V/V/V/V)为展开剂,按“1.3.4”法进行测定。C.I.71、C.I.85、C.I.90和C.I.113这4种荧光增白剂都为二磺酸型(见图5),其中 C.I.71和C.I.90结构相近(都含有C-O)、C.I.85和C.I.113结构相近(都含有-CH2CH2OH),由TLC结果(图6)可见,虽然彼此Rf相近不能完全分离,但无拖尾现象,可通过下一步SERS法进一步确认。由图6可知每个增白剂出现2个色谱斑点,这可能因为该类分子结构中含有碳碳双键(C=C),少量被氧化生成极性稍小的杂质所致,所以应以斑点大、Rf值相对较低者作为主斑点,即判定斑点。

|
| 图 5 4种二磺酸型荧光增白剂结构式 |

|
| 图 6 4种二磺酸型荧光增白剂的薄层色谱 |
2.4 对照品拉曼光谱与TLC-SERS比较
分别取C.I.71、C.I.85、C.I.90和C.I.113对照品粉末少量,置于显微成像拉曼光谱仪显微镜下直接检测其拉曼光谱,再参照“1.3.4”分别检测C.I.71、C.I.85、C.I.90和C.I.113的TLC-SERS。结果显示(图7),4种荧光增白剂对照品粉末的拉曼光谱(图7(a))彼此有显著差异,说明能反应不同成分的指纹结构信息,可作为常量成分的高专属性鉴别方法。对于单个成分而言,每种荧光增白剂的TLC-SERS与其相应的拉曼光谱特征峰虽有一定差异(图7(c)-7(f)),但各组分的TLC-SERS(图7(b))有显著差异,可彼此进行区分,专属性较强,且通过灵敏度考察可知灵敏度明显提升,故可作为混合体系中相应微量成分的高专属性鉴别方法。

|
| 图 7 对照品拉曼光谱图与TLC-SERS图 a-d分别为C.I.71、C.I.85、C.I.90、C.I.113对照品拉曼光谱图;a'-d'分别为C.I.71、C.I.85、C.I.90、C.I.113对照品TLC-SERS图。 |
2.5 真实样品检测
随机抽取100批次市售一次性纸杯,以C.I.71、C.I.90、C.I.113、C.I.85为对照品,按“1.3.4项下TLC-SERS鉴别方法”检测,结果显示,其中有6批样品中检出C.I.113,100批样品中均未检出C.I.71、C.I.90、C.I.85,与HPLC法检测结果相同。
3 结束语本研究首先分别采用传统法与微波法制备了纳米银溶胶,并通过紫外光谱法、电镜扫描法、电势与粒径测定法等表征手段,说明采用微波法与传统法制备的银溶胶中,纳米银在形貌、光学特征、电势电位、粒径大小、粒径均匀性等方面无显著差异,且微波法具有操作简单省时,纳米颗粒密度大、粒径分布更均匀等优点,然后以常用SERS探针吡啶为目标物,通过比较上述4种金属溶胶对其拉曼光谱的增强能力,说明银溶胶具有较好的增强效果。综合考虑,确定选择微波法制备的银溶胶作为纸质食品包材中荧光增白剂检测方法中SERS的增强基底。
最后,建立了一次性纸杯中DSD-FWAs二磺酸型荧光增白剂中的4种成分(C.I.71、C.I.85、C.I.90、C.I.113)的TLC-SERS鉴别方法。由于该类物质荧光效应较强,所以使用该方法需注意荧光干扰问题。所用激光光源波长越短,干扰越强,基线漂移越严重,故本方法采用780 nm作为激光光源,可有效降低荧光干扰。所建立的方法实现了将待测组分与样品基质先分离后鉴别的目的,提高了检测结果的灵敏度及专属性,且方法简便,可为食品包装材料中荧光增白剂的检测提供新的备选方法。未来也可借助此方法检测其他类型的荧光增白剂。
| [1] |
林达源. 食品接触用塑料材料中荧光增白剂检测方法分析[J].
食品界, 2022(3): 94-96.
LIN D Y. Analysis of detection methods for fluorescent whitening agents in plastic materials used in food contact[J].
FOOD & MORE, 2022(3): 94-96.
|
| [2] |
桂亮. 荧光分光光度法在餐巾纸荧光增白剂特定迁移量测定中的应用[J].
造纸装备及材料, 2021, 50(10): 1-2.
. GUI L. Application of fluorescence spectrophotometry in the determination of specific migration amount of fluorescent whitening agents for napkins[J].
Papermaking equipment and materials, 2021, 50(10): 1-2.
|
| [3] |
叶流颖, 徐保明, 李珠叶, 等. 三嗪氨基二苯乙烯类荧光增白剂的研究进展[J].
染整技术, 2019, 41(5): 28-32.
. YE L Y, XU B M, LI Z Y, et al. Research progress on triazine amino stilbene fluorescent whitening agents[J].
Textile Dyeing and Finishing Journal, 2019, 41(5): 28-32.
|
| [4] |
SHU W, DING W. Determination of fluorescent whitening agents in infant clothes and paper materials by ion-pair chromatography and fluorescence detection[J].
J Chin Chem Soc-Taip, 2009, 56(56): 797-803.
|
| [5] |
ZHANG L, ZHAO Y L. Determination of fluorescent whitening agent in emulsion paint based on fluorescence spectrophotometry[J].
J Phys: Conference Series, 2017, 844(1): 012053-012053.
|
| [6] |
TANG J, ZHOU J, QIAN K, et al. Simultaneous determination of 18 fluorescent whitening agents in textiles by ultra performance liquid chromatography[J].
Chin J Chromatogr, 2018, 36(7): 670-677.
DOI:10.3724/SP.J.1123.2018.01043 |
| [7] |
WU Y L, XIAN Y P, GUO X D, et al. Development and validation of a screening and quantification method for simultaneous determination of seven fluorescent whitening agents in commercial flour using UPLC–MS/MS[J].
Food Chem, 2018, 243: 162-167.
DOI:10.1016/j.foodchem.2017.09.110 |
| [8] |
田陆川, 陈浩然, 姜红, 章欣, 等. 基于光谱特征提取的橡胶手套无损检验研究[J/OL]. 中国测试: 1-10[2022-10-06]. https://kns-cnki-net.webvpn.qmu.edu.cn/kcms/detail/51.1714.TB.20220331.0918.002.html.
TIAN L C, CHEN H R, JIANG H, et al. Classification of Rubber Gloves based on Differential Raman Spectroscopy and Stoichiometry[J]. China Measurement & Test:1-10[2022-10-06]. https://kns-cnki-net.webvpn.qmu.edu.cn/kcms/detail/51.1714.TB.20220331.0918.002.html.
|
| [9] |
田陆川,姜红,张馨艺,等.差分拉曼光谱检验7种芬太尼类新精神活性物质[J].中国测试, 2023, 49(10):77-82.
TIAN L C, JIANG H, ZHANG X Y, et al. Detection of seven new psychoactive substances of fentanyl by differential Raman spectroscopy[J]. China Measurement & Test, 2023, 49(10): 77-82.
|
| [10] |
LIN X, HASI W L , LOU X T, et al. Rapid and simple detection of sodium thiocyanate in milk using surface-enhanced Raman spectroscopy based on silver aggregates[J]. J Raman Spectrosc, 2014, 45(2): 162-167.
|
| [11] |
ZHANG S N, FAN Q Z, GUO J Q, et al. Surface-enhanced Raman spectroscopy tandem with derivatized thin-layer chromatography for ultra-sensitive on-site detection of histamine from fish[J]. Food Control, 2022, 138: 108987.
|
| [12] |
许凤, 孙革, 孙明睿, 等. 薄层色谱原位富集显微拉曼检测荧光增白剂[J].
食品工业, 2021, 42(2): 278-282.
. XU F, SUN G, SUN M R, et al. Determination of fluorescent whitening agents by tlc in situ enrichment micro-Raman[J].
The Food Industry, 2021, 42(2): 278-282.
|
| [13] |
尹利辉, 张雁. 正电性纳米银胶的表征及加入不同凝聚剂后的表面增强拉曼散射光谱[J].
药物分析杂志, 2010(12): 2352-2355.
. YIN L H, ZHANG Y. Character of the nano silver particles and the surface enhanced Raman of nano silver particles after adding different aggregating agent[J].
Journal Of Pharmaceutical Analysis, 2010(12): 2352-2355.
|
| [14] |
王兰, 黄少华, 黄祖芳, 等. 微波加热法快速制备纳米金及其SERS活性表征[J].
光散射学报, 2014, 26(1): 13-18.
. WANG L, HUANG S H, HUANG Z F, et al. Rapid Synthesis of Gold Colloids Assisted by Microwave Irradiation and SERS Activity Characterized[J].
The Journal of Light Scattering, 2014, 26(1): 13-18.
|
 2024, Vol. 50
2024, Vol. 50