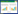文章信息
- 陶静, 陈思
- TAO Jing, CHEN Si
- 桂林桃金娘果实挥发油活性成分及抗氧化活性分析
- Analysis of active ingredients and its antioxidant activity of volatile oil in Rhodomyrtus tomentosa fruits from Guilin
- 中国测试, 2024, 50(5): 71-78
- CHINA MEASUREMENT & TEST, 2024, 50(5): 71-78
- http://dx.doi.org/10.11857/j.issn.1674-5124.2023080069
-
文章历史
- 收稿日期: 2023-08-16
- 收到修改稿日期: 2023-10-25
2. 辽宁省天然产物活性分子开发及利用重点实验室,辽宁 鞍山 114007
2. Liaoning Key Laboratory of Development and Utilization for Natural Products Active Molecules,Anshan 114007, China
桃金娘(Rhodomyrtus tomentosa),别名山稔,主要分布在中国的福建、广西、云南等地,是一种具有观赏、药用、营养保健等用途的优良野生植物资源。作为药膳同源的重要天然产物,桃金娘的根、叶和果实皆可入药,且具有不同的药理功效。根可祛风活络,收敛止泻和止血;叶可健脾益血和收敛解毒;果实具有补血、滋养和安胎的功效。桃金娘不同部位提取物在治疗消化不良、贫血、哮喘、风湿性关节炎、急慢性肠胃炎、腰肌疲劳损伤和严重的烧伤上具有较好的药用价值[1]。因此,开展桃金娘不同部位的活性成分及抗氧化能力的研究,对于揭示不同部位的药理功效具有重要的理论意义。
近年来,关于桃金娘根、叶的研究较为丰富,其富含三萜类、黄酮类、鞣酸(单宁、多酚)类、多糖类及色素类化学成分。高桂花采用GC-MS分析了桃金娘根中的挥发性成分,确定了27种挥发油成分,主要为脂肪酸及烯醇类化合物[2]。朱春福等[3]从桃金娘叶的醇提物中分离得到 10 种化合物,并以波谱分析进行了准确定性。其中,豆甾醇、山奈酚-3-O-α-L-呋喃阿拉伯糖苷、杨梅素、23-羟基委陵菜酸、2α,3β,19α,23-四羟基乌苏-12-烯-28-酸 28-O-β-D-吡喃葡萄糖苷和 laricitrin是首次在桃金娘叶中被发现的五种化学成分。另外发现 rhodomyrtone对金黄色葡萄球菌、蜡样芽孢杆菌和枯草芽孢杆菌表现出显著的抗菌活性。目前,对于桃金娘果实的研究主要集中在多糖、多酚和黄酮类物质的研究,对桃金娘果实挥发油成分的抗氧化活性研究相对较少。陈涛等[1]以超声波辅助萃取法提取广东桃金娘果实中挥发油成分并以GC-MS技术分离鉴定出33种化学物质,发现姚金娘果实挥发油的主要化学成分为具有平喘作用、治疗老年慢性支气管炎有效成分之一的反式石竹烯,上述研究表明:桂林桃金娘果实具有独特的生化及药理活性,可以作为我国重要的药食同源野生植物资源进行开发和利用。
检测对 DPPH 自由基和羟自由基(·OH)的清除能力是评价抗氧化能力的常用有效方法[4],从天然产物中寻找具有生物活性功能(如抗氧化、抗肿瘤等)新物种对于新药研制和风味食品的开发具有重要的理论和现实意义。如,雷辉等在海洋真菌 Pestalotiopsis sp.中分离纯化出一种具有抑制肿瘤细胞作用的新型甾体化合物[5];曹月等从高盐固态发酵型酱油中筛选出的 XS-4和 XS-6 两株芽孢杆菌显示出较强产酱香能力,具有良好应用前景[6]。为提高桂林桃金娘果实的开发利用水平,本研究将在确定桂林桃金娘果实挥发性活性成分的提取工艺和化学组成的基础上,重点考察挥发油成分对DPPH自由基和羟基自由基(·OH)的清除效果,为桂林桃金娘果实活性成分的开发利用提供理论基础及事实依据。
1 材料与方法 1.1 材料与试剂桃金娘干果:产地广西桂林。石油醚、七水合硫酸亚铁和水杨酸购于国药集团化学试剂有限公司;无水乙醇购于辽宁省泉瑞试剂有限公司;2,2-联苯基-1-苦基肼基购于上海麦克林生化科技股份有限公司。
1.2 仪器与设备Agilent 7000D三重四极杆气质联用仪购于美国安捷伦公司;721G可见分光光度计购于上海仪电分析仪器有限公司;旋转蒸发仪(RE-52型)购于上海亚荣生化仪器厂;低温冷却循环泵(DLSB-2/25型)购于巩义市予华仪器有限责任公司;数显恒温水浴锅(HH-S24S型)购于金坛市大地自动化仪器厂;高速多功能摇摆粉碎机(TYSP-500A型)购于浙江省永康市红太阳机电有限公司;电子天平(BS124S型)购于赛多利斯科学仪器(北京)有限公司;D-100普兰德单通道移液器购于上海吉泰科技生物公司;冰箱(BCD-215KS型)购于青岛海尔股份有限公司。
1.3 实验方法 1.3.1 溶剂提取工艺优化方案1)溶剂提取挥发油方法
参考文献方法[7-15],桃金娘果实用粉碎机粉碎、过筛后密封保存待用。准确称取桃金娘果实粉末20.00 g,添加一定体积的石油醚(60~90 ℃),在不同温度和时间条件下进行回流萃取。过滤、低温旋转蒸发浓缩后得到挥发油。利用差减法得到挥发油重量,并计算挥发油提取率。
2)单因素实验
准确称取桃金娘果实粉末20.00 g,以料液比、提取温度和提取时间作为考察因素,以桃金娘果实挥发油提取率为指标进行系列单因素实验。
单因素梯度分别为:料液比包括1∶3、1∶4、1∶5、1∶6、1∶7 g/mL;提取温度包括70、75、80、85、90 ℃;提取时间包括2、3、4、5、6 h。每进行一组试验,选定一定的因素梯度,再逐一进行其他单因素考察。
3)正交试验
根据单因素试验结果,每个因素取3个水平。设计L9 (34) 正交表,进行正交试验,得到正交优化后的提取桃金娘果实挥发油的最佳提取工艺条件,并确定最佳工艺条件下挥发油的提取率。
1.3.2 GC/MS测定条件1)色谱条件
样品通过 HP-5 型弹性石英毛细色谱柱(25 m × 0.25 mm ,0.25 μm)进行分离;进样口温度:250 ℃;程序升温条件:初始温度50 ℃,以5 ℃/min 升至230 ℃,恒温4 min。进样量:1 μL;分流比:50∶1;溶剂延迟:3 min。载气为氦气,载气流量:1 mL/min。
2)质谱条件
离子源为电子轰击源;离子源温度:230 ℃;电离电压 :70 eV;电子倍增器电压:1341 V;发射电流:34.6 μA;接口温度230 ℃;扫描范围m/z 40~500。
1.3.3 桃金娘挥发油抗氧化性测定1)DPPH自由基清除实验
参考文献中的方法[16-18],以无水乙醇配制10、12、14、16、18、20 mg/mL浓度梯度的挥发油样品溶液。取2 mL样品溶液,加入2 mL 0.1 mmol/L的DPPH-乙醇溶液,混合均匀,室温下避光反应30 min,测定体系在两个不同波长下(517 nm和519 nm)的吸光度A1,以无水乙醇代替DPPH溶液作对照组,测定吸光度A2;以无水乙醇代替样品溶液做空白组,测定吸光度A0。平行测定三次,按下列公式计算清除率:
| $ 清除率 ({\text{%}})=\left[1-\left(A_1-A_2\right) / A_0\right] \times 100 {\text{%}}$ | (1) |
2)羟基自由基(·OH)清除实验
以无水乙醇配制50、100、150、200、250、300 μg/mL浓度梯度的挥发油样品溶液。取样品溶液1 mL,依次加入1 mL的硫酸亚铁溶液(9 mmol/L)、1 mL的双氧水(8.8 mmol/L)和1 mL水杨酸乙醇溶液(9 mmol/L),充分混和均匀后,在37 ℃的恒温水浴中加热30 min,测定体系在三个不同波长下(500 nm、510 nm和520 nm)的吸光度A1;以去离子水代替样品溶液测定吸光度A0;以1 mL去离子水代替H2O2溶液做对照试验,测定吸光度A2。平行测定3次,按公式(1)计算清除率。
2 结果与分析 2.1 单因素实验结果分析 2.1.1 料液比对桂林桃金娘果实挥发油提取率的影响不同料液比下的桃金娘果实挥发油提取率变化趋势见图1。由图1可知,桃金娘果实挥发油的提取率随料液比的增加而逐渐增加。当料液比达到1∶5 g/mL时,挥发油提取率最高,达到3.86%。当料液比超过1∶5 g/mL,挥发油提取率则随着料液比的变化而逐渐减少。因此,本研究选择料液比为1∶5 g/mL为最佳提取条件。

|
| 图 1 不同料液比下的桃金娘果实挥发油提取率变化趋势图 |
2.1.2 提取温度对桂林桃金娘果实挥发油提取率的影响
提取温度对桃金娘果实挥发油提取率影响变化趋势见图2。由图2可知,当提取温度低于85 ℃时,桃金娘果实挥发油的提取率随着温度的增加而逐渐增加;当提取温度达到85 ℃时,挥发油提取率最大;当提取温度超过85 ℃时,挥发油提取率随着温度的升高而变小。因此,本研究选择85 ℃为最佳提取温度。
|
| 图 2 提取温度对桃金娘果实挥发油提取率影响变化趋势图 |
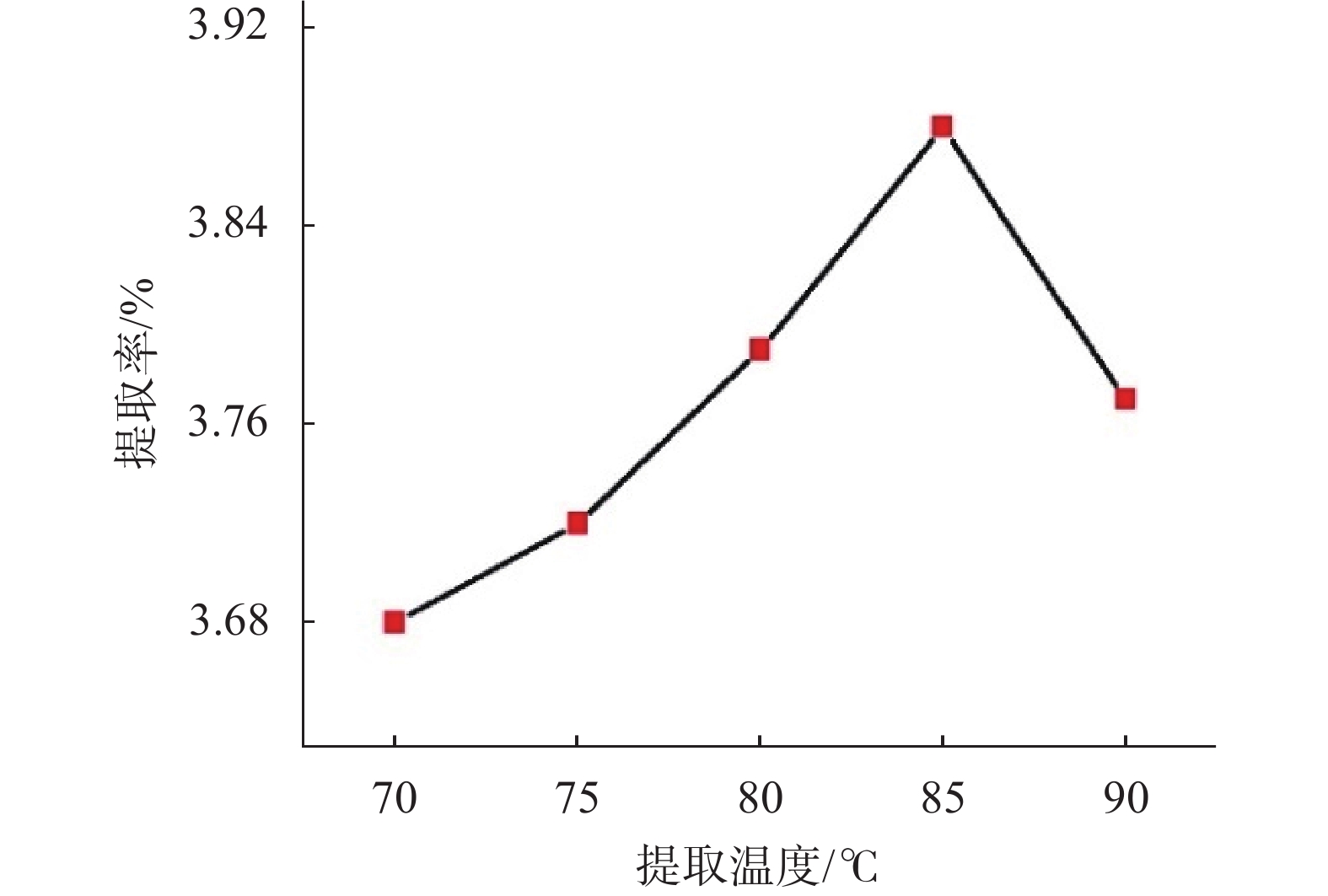
2.1.3 提取时间对桂林桃金娘果实挥发油提取率的影响
提取时间对桃金娘果实挥发油提取率的影响变化趋势见图3。由图3可知:提取时间小于4 h时,桃金娘果实挥发油的提取率随着时间的增加而逐步升高;当提取时间达到4 h时,挥发油得率最大;当提取时间超过4 h,挥发油的提取率随着时间的增加而略有下降,但趋势明显变缓。因此,本研究选择4 h为最佳提取时间。
|
| 图 3 提取时间对桃金娘果实挥发油提取率影响变化趋势图 |
综上所述,单因素实验方案下的桂林桃金娘果实挥发油的最佳提取工艺为:料液比1∶5 g/mL,提取温度85 ℃,提取时间4 h。
2.2 正交试验设计分析正交试验因素与水平设计见表1。石油醚提取桃金娘果实挥发油的正交试验结果见表2,方差结果见表3。
| 实验号 | A | B | C | D | 提取率/% |
| 料液比/(g·mL–1) |
提取温度/℃ |
提取时间/h |
空白 | ||
| 1 | 1 | 1 | 1 | 1 | 3.15 |
| 2 | 1 | 2 | 2 | 2 | 3.36 |
| 3 | 1 | 3 | 3 | 3 | 3.27 |
| 4 | 2 | 1 | 2 | 3 | 3.76 |
| 5 | 2 | 2 | 3 | 1 | 3.87 |
| 6 | 2 | 3 | 1 | 2 | 3.69 |
| 7 | 3 | 1 | 3 | 2 | 3.74 |
| 8 | 3 | 2 | 1 | 3 | 3.64 |
| 9 | 3 | 3 | 2 | 1 | 3.58 |
| K1 | 9.78 | 10.65 | 10.48 | 10.60 | |
| K3 | 10.96 | 10.54 | 10.88 | 10.67 | |
| k1 | 3.26 | 3.55 | 3.49 | 3.53 | |
| k2 | 3.77 | 3.62 | 3.57 | 3.60 | |
| k3 | 3.65 | 3.51 | 3.63 | 3.56 | |
| R | 0.51 | 0.11 | 0.14 | 0.07 | |
| 主次因素 | A>B>C | ||||
| 最优组合 | A2B2C3 | ||||
| 来源 | 偏差平方和 | 自由度 | 均方 | F值 | P值 | 显著性 |
| 料液比A | 0.432622 | 2 | 0.216311 | 70.28159 | 0.014029 | * |
| 提取温度B | 0.018822 | 2 | 0.009411 | 3.057762 | 0.246441 | |
| 提取时间C | 0.026756 | 2 | 0.013378 | 4.34657 | 0.187036 | |
| 误差 | 0.006156 | 2 | 0.003078 | |||
| 合计 | 0.484356 | 8 | 0.060544 |
根据表2正交实验结果分析可知:将料液比、提取时间和提取温度三因素的R值与空白列的R值进行比较,发现各因素的R值均大于空白列的R值,表明各因素对试验指标的影响都是有效的。各因素对桂林桃金娘果实挥发油提取率影响的主次因素顺序为料液比>提取温度>提取时间。由表3方差结果可知,料液比对结果影响显著。提取时间和提取温度对结果影响不显著。最佳工艺组合为A2B2C3,即料液比为1∶5 g/mL,提取温度为85 ℃,提取时间为5 h。与单因素实验结果相比较,料液比和提取时间没有发生变化,提取时间略有延长,由4 h变为5 h。
根据最优方案试验结果进行重复实验,测得桂林桃金娘果实挥发油提取率分别为3.85%、3.89%和3.86%,平均提取率为3.87%,相对标准偏差为0.54%,说明该工艺稳定性,重复性良好。
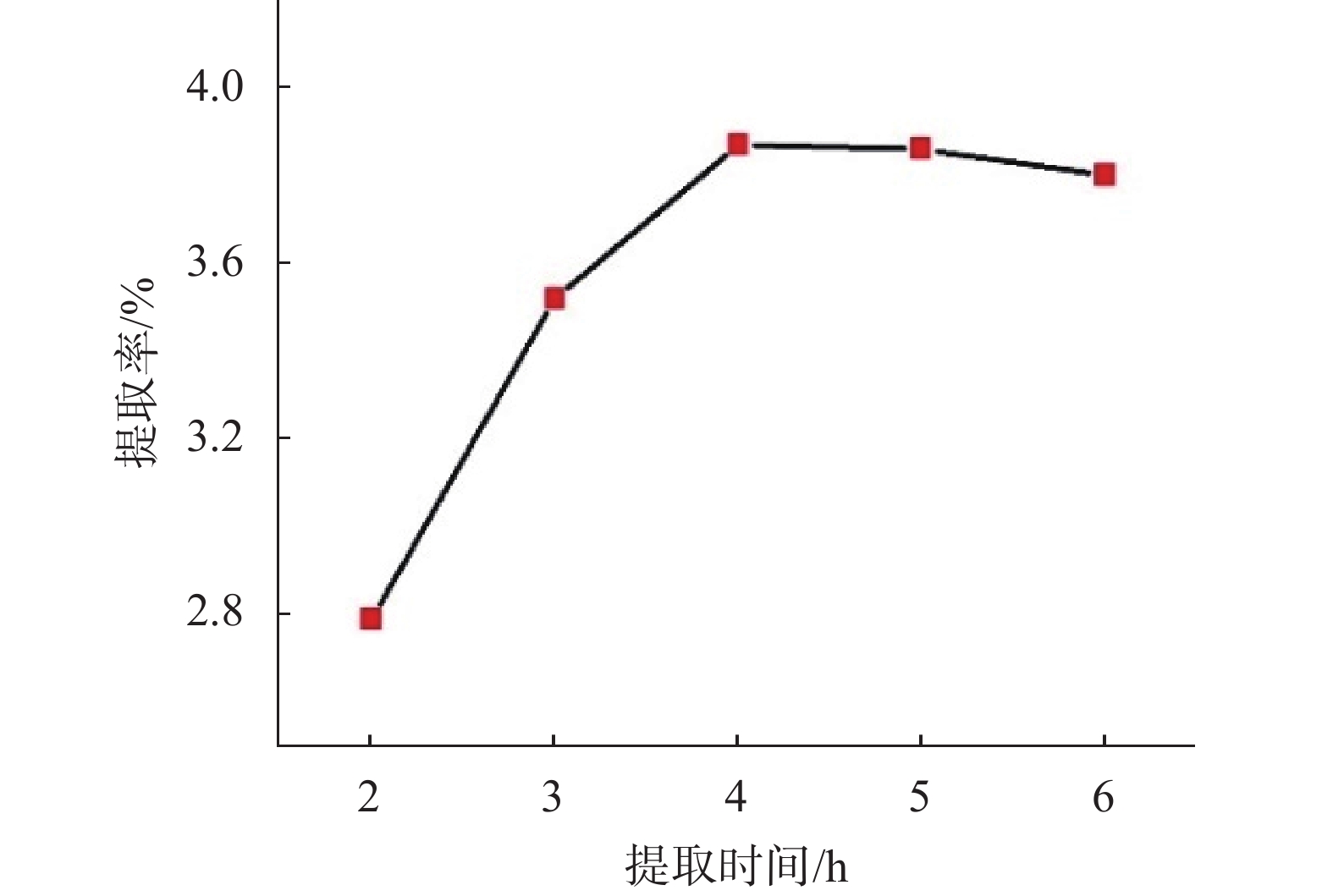
2.3 挥发油化学成分分析结果对文献方法稍作调整,获得桂林桃金娘果实挥发油样品的GC-MS分析鉴定方法[19]。利用该方法,得到最优提取条件下的桃金娘果实挥发油的总离子流图(图4)。在桂林桃金娘果实挥发油中共分离鉴定出35种组分,结果见表4。对鉴定出的各种成分进行分类,我们发现:桂林桃金娘果实挥发油中,含量1%以上的主要成分21种,占挥发油总含量的84.76%。含量最大的物质为D-柠檬烯,其次是芳樟醇。含量较大的物质包括2,6-二叔丁基-4-羟基-4-甲基环己-2,5-二烯-1-酮、反式石竹烯、桉叶油醇、乙酸芳樟酯、4-萜烯醇、α-松油醇、β-蒎烯、(+)-δ-杜松烯等。其中,D-柠檬烯具有防腐保鲜、抑菌、抗氧化、抗炎等功效,占12.0%;芳樟醇具有抗菌消炎的功效,含量为11.94%。另外还含有具有抗炎作用、对于支气管炎和鼻窦炎治疗有效的桉叶油醇和治疗皮肤炎症、消化系统溃疡和老年慢性支气管炎的有效成分之一的反式石竹烯[20-23],证明桂林桃金娘果实挥发油中含有较多的具有药用价值的活性成分,具有较好的开发和利用前景。
|
| 图 4 桃金娘果实挥发油总离子流图 |
| 序号 | 保留时间/min | 中文名称 | 英文名 | 分子式 | 相对含量/% |
| 1 | 3.23 | 4α-甲基胆甾-8,24-二烯-3β-醇 | 4α-Methylcholesta-8,24-dien-3β-ol | C28H46O | 2.26 |
| 2 | 4.02 | 桧烯 | Sabinen | C10 H16 | 2.02 |
| 3 | 4.69 | β-蒎烯 | β-Pinene | C10 H16 | 2.98 |
| 4 | 4.95 | α-松油烯 | α-Terpinene | C10 H16 | 1.19 |
| 5 | 5.28 | D-柠檬烯 | D-Limonene | C10 H16 | 12.00 |
| 6 | 5.42 | 桉叶油素 | Eucalyptol | C10 H18O | 7.08 |
| 7 | 5.99 | α-蒎烯 | α-Pinene | C10 H16 | 1.18 |
| 8 | 6.18 | γ-松油烯 | γ-Terpinene | C10 H16 | 1.87 |
| 9 | 6.32 | 3-蒈烯 | 3-Carene | C10 H16 | 0.89 |
| 10 | 6.94 | β-松油烯 | β-Terpinene | C10 H16 | 0.85 |
| 11 | 11.08 | 去乙酰华蟾毒精 | Desacetylcinobufagin | C24H32O5 | 0.17 |
| 12 | 13.04 | 芳樟醇 | Linalool | C10H18O | 11.94 |
| 13 | 13.23 | 乙酸芳樟酯 | Linalyl acetate | C12 H20O2 | 5.80 |
| 14 | 13.32 | 巨大戟醇-3,5,20-三乙酸酯 | Ingenol 3,5,20-triacetate | C26 H34O8 | 0.12 |
| 15 | 13.95 | 反式石竹烯 | Trans caryophyllene | C15H24 | 8.03 |
| 16 | 14.22 | 4-萜烯醇 | Terpinen-4-ol | C10 H18 O | 4.30 |
| 17 | 15.03 | 9,12,15-十八碳三烯酸-2-苯基-1,3-二恶烷-5-基酯 | 9,12,15-Octadecatrienoic acid 2-phenyl-1,3-dioxan-5-yl ester | C28H40O4 | 0.16 |
| 18 | 15.58 | α-石竹烯 | Humulene | C15H24 | 1.02 |
| 19 | 16.32 | 乙酸松油酯 | α-Terpinyl acetate | C12H20O2 | 1.27 |
| 20 | 16.38 | α-松油醇 | α-Terpineol | C10H18O | 3.36 |
| 21 | 16.67 | (+)-δ-杜松烯 | (+)-δ-Cadinene | C15H24 | 2.49 |
| 22 | 17.01 | 双环大根香叶烯 | Bicyclogermacrene | C15H24 | 1.02 |
| 23 | 17.05 | 香叶油酸酯 | Geranyl oleate | C28H50O2 | 0.89 |
| 24 | 17.72 | 乙酸橙花酯 | Nerylacetate | C12H20O2 | 1.18 |
| 25 | 18.67 | 8,14-仲-3,19-环氧雄甾烷-8,14-二酮,17-乙酰氧基-3β-甲氧基-4,4-二甲基 | 8,14-Seco-3,19-epoxyandrostane-8,14-dione,17-acetoxy-3β-methoxy-4,4-dimethyl | C24H36O6 | 0.29 |
| 26 | 19.68 | 香叶醇 | Geraniol | C10H18O | 0.94 |
| 27 | 20.92 | 2,3,4,5-四氢-1H-吡啶并[4,3-b]吲哚,N,N'-二甲基 | 2,3,4,5-Tetrahydro-1H pyrido[4,3-b]indole, N,N'-dimethyl | C13H16 N2 | 0.16 |
| 28 | 22.17 | 9,12,15-十八碳三烯酸-2-苯基-1,3-二恶烷-5-基酯 | 9,12,15-Octadecatrienoicacid, 2-phenyl-1,3-dioxan-5-yl ester | C28H40O4 | 0.32 |
| 29 | 24.49 | 醋酸氢化可的松 | Hydrocortisone Acetate | C23H32O6 | 0.34 |
| 30 | 26.95 | 2,6-二叔丁基-4-羟基-4-甲基环己-2,5-二烯-1-酮 | 2,6-Di-tert-butyl-4-hydroxy-4-methylcyclohexa-2,5-dien-1-one | C15H24O2 | 11.09 |
| 31 | 30.43 | 粪甾烷 | Coprostane | C27 H48 | 0.95 |
| 32 | 34.13 | (+-)5,5-二甲基-4-(3-氧丁基)二氢2(3H)-呋喃酮-4-(2.4-二硝基苯肼) | (+-)-5,5-Dimethyl-4-(3-oxobutyl)dihydro-2(3H)-furanone4-(2,4-dinitrophenylhydrazone) | C16H20N4O6 | 1.33 |
| 33 | 34.67 | 对苯二甲酸二丁酯 | dibutyl terephthalate | C16H22O4 | 1.35 |
| 34 | 34.89 | 青蒿素 | Propanoic acid,2-methyl | C24H34O6 | 0.51 |
| 35 | 37.28 | 豆甾烷 | Stigmastane | C29H52 | 0.51 |
2.4 桃金娘果实挥发油抗氧化能力分析
我们详细考察了不同波长下桃金娘果实挥发油对 DPPH 自由基清除能力,结果见图5。由图5可知:在517 nm 和 519 nm 两个不同波长下,随着挥发油浓度的增加,DPPH 自由基实验清除率逐渐增大。当浓度达到 14 mg/mL 时,对 DPPH 自由基的清除率达到最大值。随着浓度的进一步增加,清除率逐步下降。桂林桃金娘果实挥发油在浓度为 14 mg/mL 时,517 nm 和 519 nm 下 DPPH 自由基清除率分别达到 97.53% 和 97.14%。表5给出了对应的方差分析结果。由表5可知:挥发油样品溶液的浓度和检测波长对清除率均具有显著性影响,但影响程度不同:样品溶液浓度对清除率的影响为极显著,波长对清除率的影响具有显著性。

|
| 图 5 不同波长下桃金娘果实挥发油对DPPH自由基清除能力 |
| 变异来源 | 平方和 | 自由度 | 均方 | F | Fα | 显著性 |
| 检测波长 | 0.141 | 1 | 0.141 | 14.929 | F0.05(5,5)= 5.05 | * |
| 溶液浓度 | 158.233 | 5 | 31.647 | 3354.771 | F0.01(1,5)= 16.26 | ** |
| 误差 | 0.047 | 5 | 0.009 | |||
| 总和 | 158.421 | 11 |
图6给出了500 nm、510 nm和520 nm下,不同浓度桃金娘果实挥发油对羟基自由基(·OH)的清除率。如图6所示,在不同波长下,随着挥发油溶液浓度的逐渐增加,羟基自由基(·OH)的清除率稳步升高。当浓度达到200 μg/mL时,清除率达到最大值,然后随着浓度的继续增加,清除率显著下降。实验结果表明:三个不同波长下,浓度为200 μg/mL的桂林桃金娘果实挥发油显示了很好的抗氧化效果,对羟基自由基(·OH)清除率最高,分别达到了84.76%、85.33%和84.65%。根据表6的方差分析结果分析可知:样品溶液浓度对清除率的影响极显著,波长对清除率影响不具有显著性。
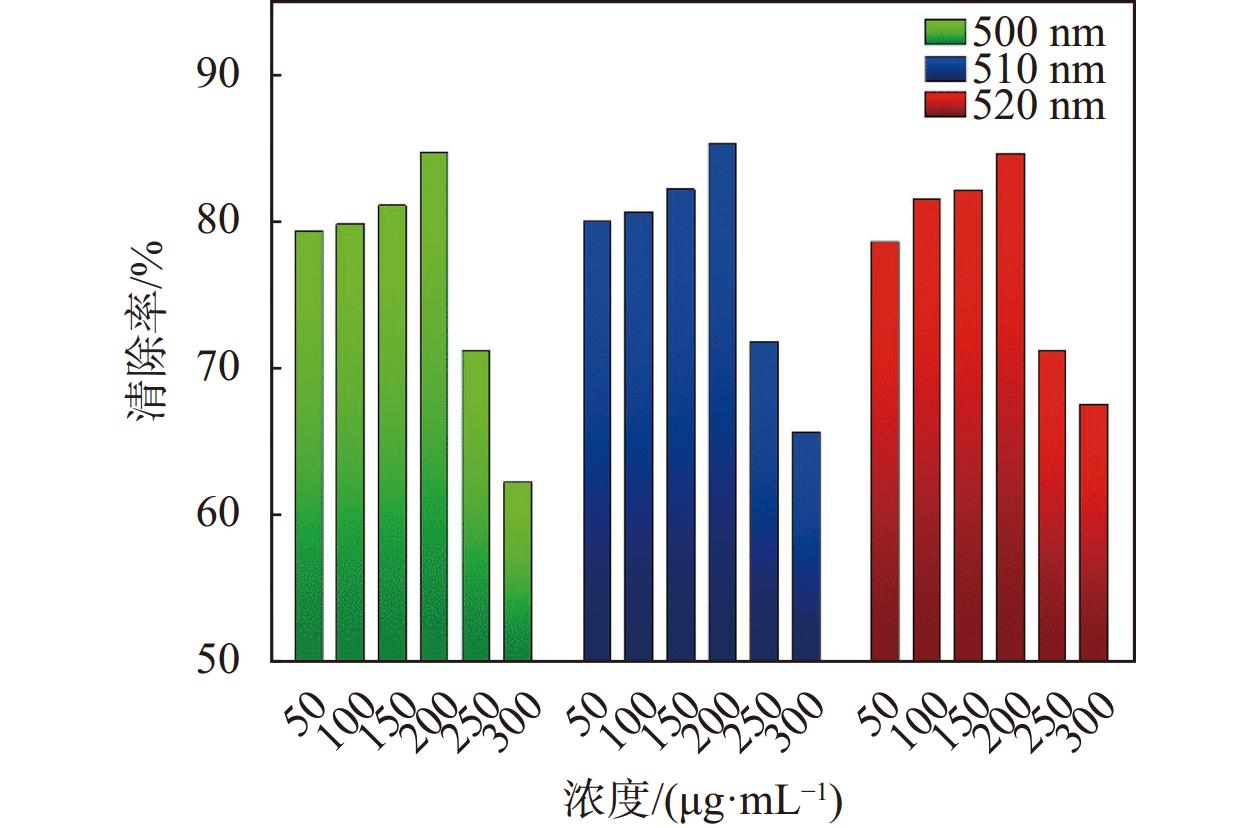
|
| 图 6 不同波长下桃金娘果实挥发油对羟基自由基(·OH)的清除能力 |
| 变异来源 | 平方和 | 自由度 | 均方 | F | Fα | 显著性 |
| 检测波长 | 5.560 | 2 | 2.781 | 2.205 | F0.05(2,10) = 4.10 | |
| 溶液浓度 | 829.975 | 5 | 165.995 | 131.597 | F0.01(5,10) = 5.64 | ** |
| 误差 | 12.614 | 10 | 1.261 | |||
| 总和 | 848.150 | 17 |
综合上述研究结果,我们发现:桂林桃金娘果实挥发油对 DPPH 自由基和羟基自由基(·OH)都具有较强的清除作用,清除率皆达到 85% 以上。其中,对 DPPH 自由基的清除能力要略强于对羟基自由基(·OH)的清除能力。
3 结束语通过正交实验确定桂林桃金娘果实中挥发油的最佳提取工艺,并以GC-MS分析了最佳提取工艺下的挥发油成分,从其中分离鉴定出35种组分,主要成分为D-柠檬烯(12.0%)和芳樟醇(11.94%)。抗氧化性研究表明:桃金娘果实挥发油对DPPH自由基和羟基自由基(·OH)具有较强的清除作用。因此,桂林桃金娘果实挥发油具有较好的抗氧化活性和较高的药用开发价值。
| [1] |
陈涛, 余楚国, 夏雪奎, 等. 山稔子挥发油化学组成研究[J].
中山大学学报(自然科学版), 2007, 194(6): 135-137.
CHEN T, YU C G, XIA X K, et al. .Analysis of volatile components from the fructus rhodomyrti[J].
Acta Scientiarum Naturalium Universitatis Sunyatseni, 2007, 194(6): 135-137.
|
| [2] |
高桂花. 桃金娘根中挥发性成分研究[J].
济宁医学院学报, 2015, 38(1): 26-28.
|
| [3] |
朱春福, 刘洪新, 贺峦, 等. 桃金娘叶的化学成分研究[J].
热带亚热带植物学报, 2015, 23(1): 103-108.
|
| [4] |
田圆圆, 刘绒梅, 耿 琦, 等. 四川传统腌腊肉制品中乳酸菌的分离鉴定及其抗氧化能力研究[J].
中国测试, 2018, 44(1): 54-59.
|
| [5] |
雷辉, 夏童, 王佳女, 等. 海洋真菌 Pestalotiopsis sp. 甾体化合物的分离纯化及抗肿瘤活性研究[J].
中国测试, 2023, 49(3): 60-64.
|
| [6] |
曹月, 邓岳, 徐小芳, 等. 自然发酵酱油酱醅中产香芽孢杆菌的筛选及其产酶性能研究[J].
中国测试, 2021, 47(8): 58-64.
|
| [7] |
何颖. 中药挥发油提取方法分析[J].
天津药学, 2015, 27(1): 47-50.
|
| [8] |
伍振峰, 王赛君, 杨明, 等. 中药挥发油提取工艺与装备现状及问题分析[J].
中国实验方剂学杂志, 2014, 20(14): 224-228.
|
| [9] |
于赟, 陈川. 中药挥发油提取技术及生物活性的研究进展[J].
上海中医药大学学报, 2014, 28(2): 75-78.
|
| [10] |
颜永刚, 郭晓恒, 邓翀. 云南产野生和栽培薄荷中挥发油的GC-MS比较分析[J]. 中草药. 2011, 42(6): 1090-1092.
YAN Y G, GUO X H, DENG C. Comparative analysis on essential oil in wild and cultivated Mentha haplocalyx from Yunnan Province by GC-MS[J]. Chinese Traditional and Herbal Drugs, 2011, 42(6): 1090-1092.
|
| [11] |
邵佩, 张雨迎, 钟琳, 等. 薄荷油的提取、药理作用及微胶囊化研究进展[J].
食品与机械, 2022, 38(2): 235-240.
|
| [12] |
王万, 原红果, 陈博, 等. 中药挥发油研究现状探讨[J].
时珍国医国药, 2006, 17(5): 848-850.
|
| [13] |
梁洁怡, 徐阳纯, 李维嘉, 等. 桃金娘果实中挥发油提取工艺的优化及GC-MS鉴定[J].
食品工业, 2018, 39(12): 124-127.
|
| [14] |
吴萍萍, 尹艳艳, 朱宝君, 等. 不同方法提取山稔子挥发油的比较研究[J].
香料香精化妆品, 2015, 1: 9-13.
|
| [15] |
陈文芬. 桃金娘精油的提取及其降亚硝酸盐活性研究[D]. 广州: 华南理工大学, 2011(12).
CHEN W F. Study on extraction of essential oil from Rhodomyrtus tomentosa (Ait.) Hassk and the effect on the activity of nitrite reduction[D]. Guangzhou: South China University of Technology, 2011.
|
| [16] |
宋歌, 夏娇, 肖强. 湖北黄精叶片挥发油GC-MS分析及抗氧化活性测定[J].
湖北民族大学学报(自然科学版), 2022, 40(4): 374-379,384.
|
| [17] |
郑燕菲, 张强, 蓝亮美, 等. 八角茴香壳与籽中挥发油成分分析及抗氧化性研究[J].
粮食与油脂, 2022, 35(5): 83-86.
|
| [18] |
韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J].
食品科学, 2014, 35(9): 317-322.
|
| [19] |
陶静, 翁霞, 王喜珠. 甘谷伏椒挥发油成分及抗氧化活性研究[J].
中国调味品, 2024, 49(4): 79-84.
|
| [20] |
王曼笛. 艾草精油主要化合物桉叶油醇的抑菌机理及艾草精油Pickering乳液抑菌作用研究[D]. 郑州: 河南工业大学, 2022.
WANG M D. Antibacterial mechanism of the main compounds in Artemisia argyi essential oil-eucalyptol and antibacterial effect of Artemisia argyi essential oil pickering emulsion[D]. Zhengzhou: Henan University of Technology, 2022.
|
| [21] |
肖婷, 崔炯谟, 李倩, 等. 桃金娘的化学成分、药理作用和临床应用研究进展[J].
现代药物与临床, 2013, 28(5): 800-805.
|
| [22] |
刘晓宇, 陈旭冰, 陈光勇. β-石竹烯及其衍生物的生物活性与合成研究进展[J].
林产化学与工业, 2012, 1: 108-114.
|
| [23] |
陈丽珍. 山稔子的有效成分及其药食应用研究进展[J].
亚太传统医药, 2012, 8(6): 212-213.
|
 2024, Vol. 50
2024, Vol. 50