文章信息
- 焦雪, 刘文昊, 马明建, 钱昊, 许晓玲, 王琼丹, 吴庆
- JIAO Xue, LIU Wenhao, MA Mingjian, QIAN Hao, XU Xiaoling, WANG Qiongdan, WU Qing
- 基于Mo/CeO2纳米模拟酶的活性抑制检测银离子
- Determination of Ag+ based on activity inhibition of Mo/CeO2 NPs mimic enzyme
- 中国测试, 2018, 44(8): 52-56
- CHINA MEASUREMENT & TEST, 2018, 44(8): 52-56
- http://dx.doi.org/10.11857/j.issn.1674-5124.2018.08.010
-
文章历史
- 收稿日期: 2018-03-06
- 收到修改稿日期: 2018-04-12
重金属Ag+因具有良好的光、电学特性被广泛应用于各个行业,每年有大量的含Ag+废水排放到环境当中,成为重金属污染最严重的离子之一[1-2]。如果人长期暴露在高浓度的银离子环境或者通过食物链的富集进入人体,都会对人体造成一定的损害,特别是对大脑、神经及免疫系统的伤害[3]。因此需要建立一种快速、灵敏的传感器可实时监测排放废水及地表水中的Ag+浓度。目前Ag+检测常用检测方法主要是荧光光谱法[4]、电化学分析法[5]、原子吸收光谱法[6]、表面增强拉曼光谱法[7]和电感耦合等离子质谱法[8]等,但这些方法都存在各自的缺点,如需要大型仪器,前期样品处理复杂、耗时较长、不易携带等。近年来,纳米技术的蓬勃发展为重金属离子的检测提供了新思路,许多基于纳米材料建立起来的检测重金属的化学生物传感器被研究报道[9-11]。如Yang等[12]利用Ag+能和富含C碱基的DNA构成特殊的结构而被绿色荧光染料识别,构建了一种简单快速检测Ag+的荧光方法;Hu等[13]通过Ag+能够加速肽链修饰的Au纳米颗粒团聚的作用,采用比色法简单快速超灵敏检测Ag+。尽管如此,基于纳米材料的特殊性质开发的传感器方法在设计和方法灵敏度上需要进一步提高。
自2007年,阎锡蕴课题组[14]发现Fe3O4纳米材料具有过氧化物模拟酶性质之后,许多金属纳米粒子(如贵金属纳米粒子金属氧化物和碳纳米材料[15]等)较好酶的活性被研究。纳米材料模拟酶与天然酶相比,能克服天然酶不耐高温、不耐pH和易于失活等缺点,因此纳米材料获得了广泛的关注。近年来,基于纳米材料的模拟酶特性建立的检测重金属离子的方法得到了发展,如Yang等合成了MnO2纳米棒并证明该材料具有过氧化物模拟酶的特性,谷胱甘肽能抑制其模拟酶特性使TMB褪色,而Hg2+加入可以使TMB重新显色,基于此建立了高灵敏检测Hg2+的方法;Zhang等制备了rGO/PEI/Pd杂交纳米材料,当加入Hg2+时其催化活性增强,建立了快速低检出限的Hg2+检测方法;Song等通过柠檬酸和硼氢化钠还原制备高分散性的Pt纳米粒子,由于其中的柠檬酸可以将Ag+还原成为Ag0,而Ag0又覆盖到Pt纳米粒子上抑制其纳米酶催化活性,建立检测Ag+的传感器。
本文通过简单的微波辅助合成方法制备了具有过氧化物模拟酶特性的Mo/CeO2 NPs,当Ag+存在时会对其催化活性产生强烈的抑制作用,基于此构建了高灵敏的Ag+比色检测方法。该方法具有灵敏度高、选择性好、操作简便、检测快速、成本低等优点,可潜在应用于实际样品的检测。
1 实验部分 1.1 仪器与试剂T9CS型双光束子紫外可见分光光度计(中国惠普有限公司),KM-36C型超声波清洗机(广州市科洁盟实验仪器有限公司),ME204E型电子分析天平(梅特勒-托利多仪器有限公司),微波反应器(GEM公司),DK-98-11电热恒温水浴锅(天津市泰斯特仪器有限公司),PHS-25型PH指示剂(上海仪电科学仪器)、硝酸铈(Ce(NO3)3·6H2O,阿拉丁工业公司), 钼酸铵((NH4)6Mo7O24·4H2O,阿拉丁工业公司),3,3′,5,5′-四甲基联苯盐酸盐(TMB·2HCl,无水级,98%,阿拉丁工业公司)、30%过氧化氢、硝酸银(AgNO3)、乙酸钠、冰醋酸、硼酸,所有试剂均为国产分析纯试剂。实验用水由NEX UP纯水系统(韩国Human公司) 制备的超纯水(18.2 MΩ·cm)。
1.2 Mo/CeO2 NPs的制备准确称取0.222 4 g (NH4)6Mo7O24·4H2O与0.790 3 g Ce(NO3)3·6H2O置于50 mL烧杯中,加20 mL去离子水溶解,不断搅拌并缓慢滴加0.1 mol/L的NaOH溶液至pH等于12.0,继续搅拌10 min。将溶液放入微波反应器,在100 ℃下反应4 h。反应完成后,离心收集反应产物,去离子水洗涤3次。放入真空干燥箱,在80 ℃下干燥6 h。
再分散溶液:上述样品用玛瑙研钵研细,称取0.002 4 g,加入4 mL去离子水。放入超声波清洗机中超声分散均匀。制得0.6 mg/mL的样品分散液。
1.3 Mo/CeO2 NPs模拟酶活性的测定以TMB·2HCl为反应底物,测定Mo/CeO2 NPs的过氧化物模拟酶的性质。具体实验步骤为:依次将2 mL醋酸钠缓冲溶液(0.2 mol/L,pH = 4.0)、10 μL 0.6 mg/mL的样品分散液、100 μL H2O2溶液(10 mmol/L)、100 μL的TMB·2HCl (5 mmol/L)溶液加入到4 mL的Ep管中。在40 ℃下孵育30 min,在652 nm处测量紫外吸收。
1.4 银离子的检测于2 mL的Ep管中分别吸取1.7 mL的不同pH的缓冲溶液,然后分别加10 μL Mo/CeO2 NPs分散液(0.6 mg/mL),100 μL H2O2溶液(10 mmol/L),100 μL的TMB·2HCl (5 mmol/L)溶液振荡后,于最优温度45 ℃孵育5 min,移取100 μL的AgNO3 (0.25 mmol/L)在45℃下孵育10 min在652 nm处测紫外吸收。
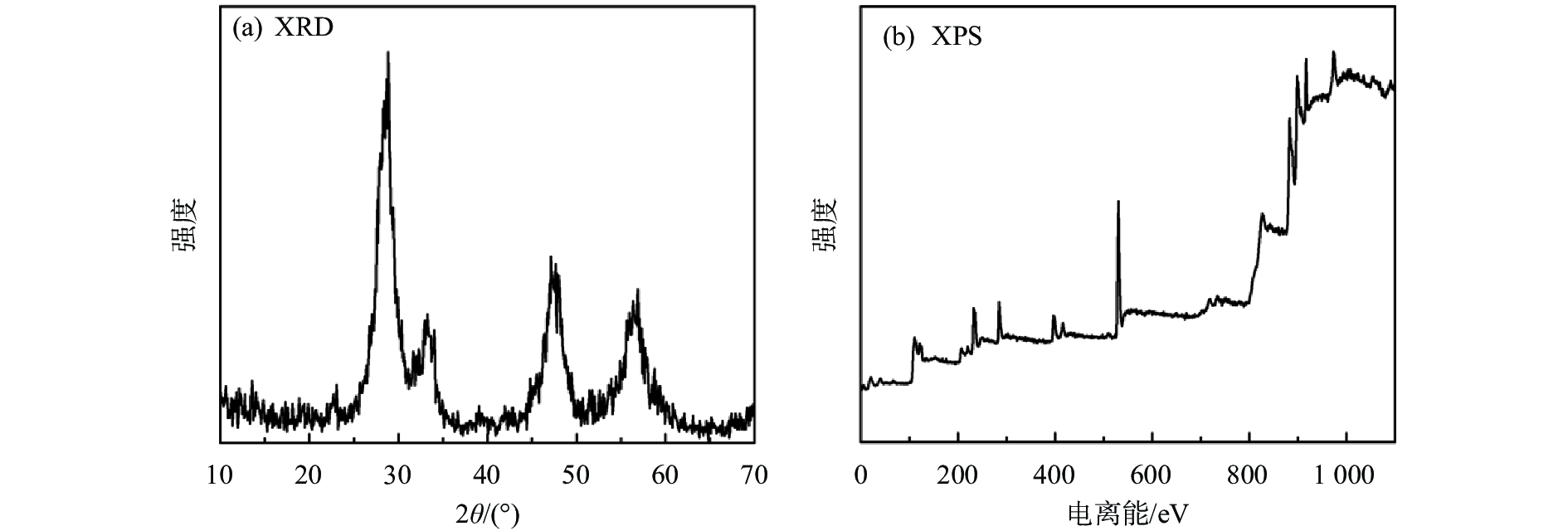
2 结果与讨论 2.1 Mo/CeO2 NPs的表征图1(a)为Mo/CeO2NPs的X-射线粉末衍射(XRD)图,该晶体衍射图与CeO2标准图谱一致。该纳米材料具有立方萤石结构,但从XRD图中未发现其他杂质峰,可能是由于掺杂的Mo含量较少,所以在XRD中没有出现Mo元素的衍射峰。Mo/CeO2 NPs的元素分析和电子状态可以通过X-射线光电子能谱(XPS)进行表征分析,图1(b)显示了Mo/CeO2 NPs的XPS全谱,在230~238 eV范围内出现了Mo 3d的谱图,证明通过该方法合成的材料中掺杂有Mo离子。同时,通过XPS可以获得Ce的光谱图,可分为两个部分:875~895 eV的峰属于Ce 3d5/2和895~910 eV的峰属于Ce 3d3/2,与文献报道结果一致。图2(a)是在最优条件下合成的Mo/CeO2 NPs的扫描电子显微镜(SEM)图,图中表明合成的材料呈现不规则颗粒状,有少量团聚,粒径尺寸分布不均。为了进一步证明该材料由小的纳米颗粒形成,通过原子力显微镜(AFM)图(图2(b))所示,该材料由粒径大约为25 nm的小颗粒团聚而成,表面不光滑,纳米材料厚度不均一。
|
| 图 1 Mo/CeO2 NPs的XRD图和XPS图 Fig. 1 a. XRD pattern of Mo/CeO2 NPs b. XPS spectrum of Mo/CeO2 NPs |

|
| 图 2 Mo/CeO2NPs的SEM图和AFM图 Fig. 2 a. SEM image of Mo/CeO2 NPs b. AFM image of Mo/CeO2 NPs |
2.2 Mo/CeO2 NPs的过氧化物酶的特性
为了探究Mo/CeO2 NPs的模拟酶活性,以过氧化物酶的底物(TMB·2HCl)为显色底物,H2O2为氧化底物,Mo/CeO2 NPs作为催化剂,考察该体系的显色反应,评价其过氧化物模拟酶的催化特性。在0.2 mol/L NaAc缓冲溶液(pH 4.0)中,Mo/CeO2 NPs能够催化H2O2氧化TMB·2HCl产生经典显色反应。氧化TMB在652 nm处有特征吸收峰出现,证明了Mo/CeO2 NPs具有类似天然辣根过氧化物酶的活性。
实验发现,银离子可以抑制Mo/CeO2 NPs光催化模拟酶的活性,基于此可建立检测银离子的方法,其检测原理如图3所示。Mo/CeO2 NPs具有类过氧化物酶活性,可催化TMB· 2HCl与H2O2的显色反应,使溶液呈蓝色。向体系中加入Ag+后,可明显抑制显色反应的进行,导致溶液颜色变浅。基于此建立了Ag+的识别体系,通过测量体系紫外-可见吸收光谱的变化定量测定的Ag+浓度。

|
| 图 3 不同反应体系的测定结果 Fig. 3 (A) Images of different systems (B) Absorption spectra of different systems |
2.3 体系pH值和温度对Mo/CeO2 NPs模拟酶催化活性的影响
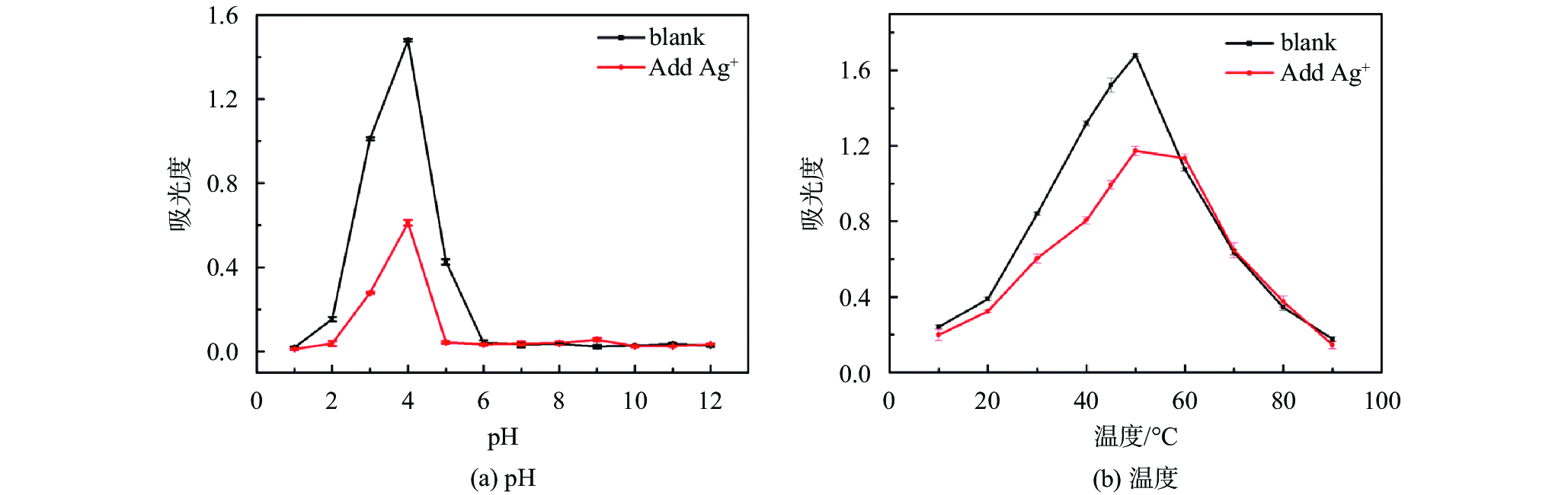
Mo/CeO2 NPs同其他无机纳米材料过氧化物模拟酶和天然酶HRP一样,其催化活性受体系的pH和温度的影响。同时考察加入Ag+后的催化活性受体系的pH和温度的影响。实验固定温度为25 ℃,记录pH从1.0~12.0变化时特征吸收峰的变化;再固定pH为4.0,记录温度从10 ℃到90 ℃时的变化。如图4所示,对于Mo/CeO2 NPs模拟酶来说,当pH为4.0和温度为50 ℃时,该模拟酶催化活性最大。而相对于加入Ag+后的抑制体系,考察体系pH和温度对于该催化活性抑制的影响,优化其最佳pH为4.0,最适温度为45 ℃。因此,pH为4.0,温度为45 ℃作为最佳反应条件应用于接下来的分析检测中。
|
| 图 4 pH和温度对Ag+加入前后体系体系活性的影响 Fig. 4 Effect of pH (a) and temperature (b) on peroxidase like activity of Mo/CeO2 NPs and the system of Ag+added |
2.4 Ag+的检测
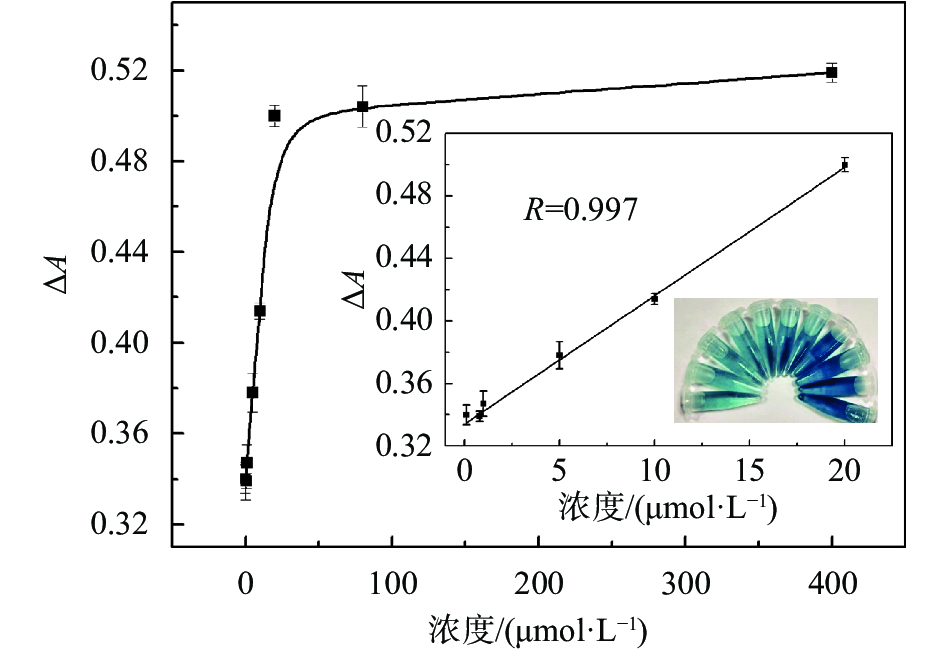
在最优实验条件下,测定了不同浓度Ag+存在时,溶液的吸光度差值与Ag+浓度的关系图。如图5所示,随着Ag+浓度增大,体系在652 nm处的吸吸收值不断减小,其吸光度差值逐渐增加,说明Mo/CeO2 NPs的催化活性被逐渐抑制,其中插图为线性关系图及不同浓度的比色图片。通过比色法对Ag+检测线性范围为 1.0×10–7~2.0×10–5 mol/L,检出限为0. 9×10–7 mol/L。本实验可应用于实际样品的检测,利用实验室自来水作为样品,通过ICP-MS检测其含量,向样品中加标,使Ag+的浓度达到5×10–7,1×10–6,2×10–6 mol/L,过滤后检测。其3个加标浓度下的回收率分别为96.8%,98.4%和102.7%,相对标准偏差分别为6.6%,5.4%和5.0%。上述结果表明,利用Mo/CeO2 NPs在实际样品中检测Ag+的方法具有较高的准确性和可靠性。本文建立的比色方法简便快捷,无需复杂仪器,耗时短,反应条件较温和,相较于其他检测方法具有较好优势。
|
| 图 5 Mo/CeO2 NPs作为模拟酶检测Ag+的响应曲线(插图为线性关系图) Fig. 5 Ag+ concentration response curve for Ag+ detection using H2O2 and the Mo/CeO2 NP catalyst (inset: linear calibration plot for Ag+) |
2.5 干扰性实验
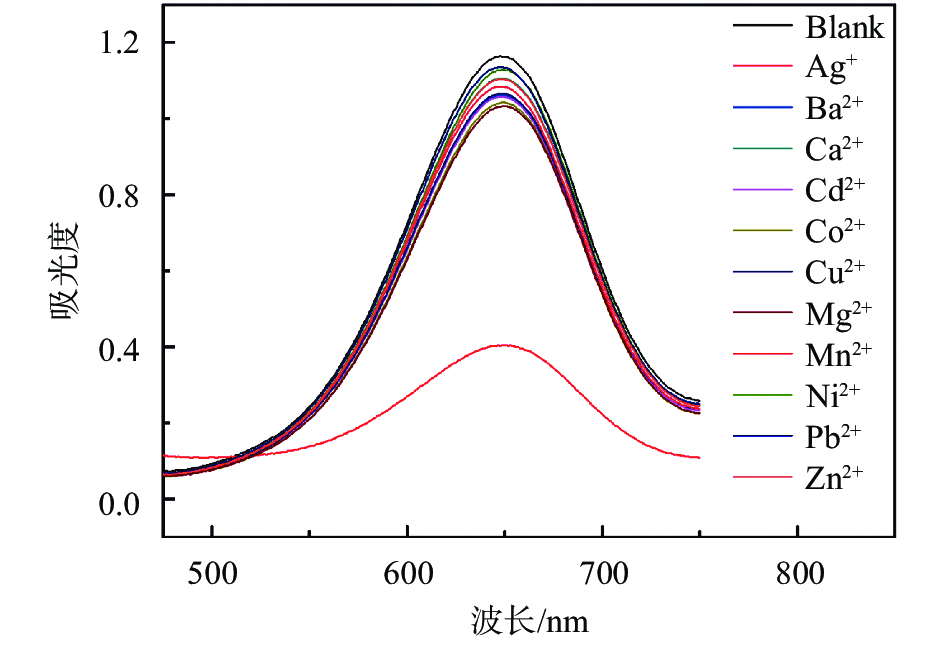
考察了几种可能存在的干扰物质,包括以下离子(Ba2+,Ca2+,Cd2+,Co2+,Cu2+,Mn2+,Ni2+,Pb2+,Zn2+)对比色测定Ag+的影响,干扰物质的浓度均为Ag+浓度的5倍。如图6所示,除Mn2+对Mo/CeO2 NPs的催化活性有轻微抑制作用,其他离子均未引起显色反应明显的变化,说明本方法具有较好的选择性。
|
| 图 6 不同离子对比色法测定Ag+的选择性影响 Fig. 6 Selectivity analysis for Ag+detection by monitoring the relative absorbance |
3 结束语
本文采用一种简单的水热法合成了具有模拟酶催化活性的Mo/CeO2 NPs,考察了Ag+对Mo/CeO2 NPs催化作用的影响。Mo/CeO2 NPs催化TMB-H2O2的反应产生有色产物,Ag+可以抑制Mo/CeO2 NPs的催化活性,在最佳实验条件下,实现了Ag+的快速、灵敏、选择性好的比色检测。此检测体系具有仪器简单,灵敏度高,检出限低,方便快速等优点。
| [1] |
KOKURA S, HANDA O, TAKAGI T, et al. Silver nanoparticles as a safe preservative for use in cosmetics[J].
Nanomedicine, 2010, 6(4): 570-574.
DOI:10.1016/j.nano.2009.12.002 |
| [2] |
MCGILLICUDDY E, MURRAY I, KAVANAGH S, et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology[J].
Science of the Total Environment, 2017(575): 231-246.
|
| [3] |
SREEKUMARI KR. Silver containing stainless steel as a new outlook to abate bacterial adhesion and microbiologically influenced corrosion[J].
Transactions of the Iron & Steel Institute of Japan, 2007, 43(11): 1799-1806.
|
| [4] |
ZHANG Y, CHEN W, DONG X, et al. Simultaneous detection of trace toxic metal ions, Pb2+and Ag+, in water and food using a novel single-labeled fluorescent oligonucleotide probe
[J].
Sensors and Actuators B: Chemical, 2018(261): 58-65.
|
| [5] |
XU G, WANG G, HE X, et al. An ultrasensitive electrochemical method for detection of Ag(+) based on cyclic amplification of exonuclease III activity on cytosine-Ag(+)-cytosine[J].
Analyst, 2013, 138(22): 6900-6906.
DOI:10.1039/c3an01320k |
| [6] |
MUSIL S, KRATZER J, VOBECKÝ M, et al. Silver chemical vapor generation for atomic absorption spectrometry: minimization of transport losses, interferences and application to water analysis[J].
Journal of Analytical Atomic Spectrometry, 2010, 25(10): 1618-1626.
DOI:10.1039/c0ja00018c |
| [7] |
WU Y, JIANG T, WU Z, et al. Internal standard-based SERS aptasensor for ultrasensitive quantitative detection of Ag(+) ion[J].
Talanta, 2018(185): 30-36.
|
| [8] |
MITRANO DM, LESHER EK, BEDNAR A, et al. Detecting nanoparticulate silver using single-particle inductively coupled plasma-mass spectrometry[J].
Environmental Toxicology & Chemistry, 2011, 31(1): 115-121.
|
| [9] |
GUO L, MAO L, HUANG K, et al. Pt–Se nanostructures with oxidase-like activity and their application in a selective colorimetric assay for mercury(II)[J].
Journal of Materials Science, 2017, 52(18): 10738-10750.
DOI:10.1007/s10853-017-1181-8 |
| [10] |
SINGH S, MITRA K, SHUKLA A, et al. Brominated Graphene as Mimetic Peroxidase for Sulfide Ion Recognition[J].
Anal Chem, 2017, 89(1): 783-791.
DOI:10.1021/acs.analchem.6b03535 |
| [11] |
HASSANZADEH J, KHATAEE A, ESKANDARI H. Encapsulated cholesterol oxidase in metal-organic framework and biomimetic Ag nanocluster decorated MoS 2 nanosheets for sensitive detection of cholesterol[J].
Sensors and Actuators B: Chemical, 2018, 259: 402-410.
DOI:10.1016/j.snb.2017.12.068 |
| [12] |
YANG Q, LI F, HUANG Y, et al. Highly sensitive and selective detection of silver(i) in aqueous solution with silver(i)-specific DNA and Sybr green I[J].
Analyst, 2013, 138(7): 2057-2060.
DOI:10.1039/c3an36496h |
| [13] |
LI X, WU Z, ZHOU X, et al. Colorimetric response of peptide modified gold nanoparticles: an original assay for ultrasensitive silver detection[J].
Biosensors & Bioelectronics, 2017(92): 496-501.
|
| [14] |
GAO L, ZHUANG J, NIE L, et al. Intrinsic peroxidase-like activity of ferromagnetic nanoparticles[J].
Nature Nanotechnology, 2007, 2(9): 577-583.
DOI:10.1038/nnano.2007.260 |
| [15] |
TAO Y, LIN Y, HUANG Z, et al. Incorporating graphene oxide and gold nanoclusters: a synergistic catalyst with surprisingly high peroxidase-like activity over a broad pH range and its application for cancer cell detection[J].
Advanced Materials, 2013, 25(18): 2594-2599.
DOI:10.1002/adma.201204419 |
 2018, Vol. 44
2018, Vol. 44



