文章信息
- 夏伯姗, 王振磊, 李岱庆, 王曼, 王鸿芡, 张梅, 秦永平, 南峰, 向瑾
- XIA Boshan, WANG Zhenlei, LI Daiqing, WANG Man, WANG Hongqian, ZHANG Mei, QIN Yongping, NAN Feng, XIANG Jin
- UPLC-MS/MS法同时测定人血浆中氯沙坦及其代谢物浓度
- An UPLC-MS/MS method for simultaneous determination of losartan and metabolites in human plasma
- 中国测试, 2018, 44(7): 61-67, 82
- CHINA MEASUREMENT & TEST, 2018, 44(7): 61-67, 82
- http://dx.doi.org/10.11857/j.issn.1674-5124.2018.07.012
-
文章历史
- 收稿日期: 2018-03-09
- 收到修改稿日期: 2018-04-20
2. 四川大学华西医院国家药物临床试验机构临床药理研究室,四川 成都 610041;
3. 扬子江药业集团四川海蓉药业有限公司,四川 成都 610041
2. GCP Center/Institute of Drug Clinical Trials, West China Hospital, Sichuan University, Chengdu 610041, China;
3. Yangtze River Pharmaceutical Group-Sichuan Hairong Pharmaceutical Co., Ltd., Chengdu 610041, China
氯沙坦钾(losartan potassium)是全球第一个上市的口服非肽类血管紧张素II受体拮抗药,可以阻断内源性及外源性的血管紧张素所产生的各种药理作用,具有良好的抗高血压疗效。氯沙坦钾口服吸收良好,经首过代谢后形成羧酸型活性代谢物及其他无活性代谢物[1]。主要活性代谢物氯沙坦羧酸(losartan carboxylic acid,LCA)的降压作用为氯沙坦(losartan,LST)的10倍[2],因此在研究氯沙坦生物等效性和药代动力学时,同时测定氯沙坦和氯沙坦羧酸十分必要。同时,已有文献报道氯沙坦钾的药动学受不同代谢酶基因多样性的影响[3-4],有必要积累更多的样本数据并对不同来源制剂进行生物等效性评价以获得更多临床药物应用的可靠信息。目前,国内外文献报道测定氯沙坦及其代谢物浓度的主要方法有LC-UV法[5-7]和LC-MS法,其中LC-MS法又包括HPLC-MS法[8]、HPLC-MS/MS[9-18]法以及UPLC-MS/MS法[19-20],血浆样品预处理方法有液液萃取法[5-13]、固相萃取法[14]和沉淀蛋白法[15-20]。但目前报道的方法往往难以兼顾样本前处理的简便快速、进样分析时间短、抗干扰能力强、灵敏准确、重现性好的高通量分析。本研究在以上方法的基础上加以改进,采用同位素标记的药物和代谢物作内标,乙腈沉淀蛋白后甲酸水溶液稀释进样,建立了UPLC-MS/MS法同时测定人血浆中LST及其代谢物LCA浓度方法。该方法血浆用量少,线性范围广,单个样本分析时间仅为2.1 min,每日可检测样本数高达600个,可显著提高分析人员的工作效率,适用于高通量的分析检测工作,已成功用于氯沙坦钾片(0.1 g)在健康志愿者的生物等效性研究。
1 材料与方法 1.1 方法日本SHIMADZU SIL-30 AC型高效液相色谱仪;美国AB Sciex QTRAP 5500质谱仪;德国Eppendorf公司5810R低温离心机;美国Millipore公司Milli-Q型纯水仪;法国METTLER TOLEDO公司XP205R型十万分之一电子分析天平;昆山市超声仪器有限公司KQ-300DE型数控超声波清洗器;数据采集和处理系统为Analyst 1.6.3。
1.2 药品与试剂line-height:16.3ptLST标准品,中国药品生物制品检定所,批号100597-201102,纯度99.9%;LCA标准品,加拿大Tlcpharmachem公司,批号1357-039A9,纯度99.9%;d4-LST(d4-氯沙坦,d4-losartan)标准品,加拿大Tlcpharmachem公司,2286-087A3,纯度98.6%;d4-LCA(d4-氯沙坦羧酸,d4-losartan carboxylic acid)标准品,加拿大Tlcpharmachem公司,批号2286-096,纯度98.3%。乙腈、甲酸,美国Thermo Fisher公司,色谱纯;氨水,成都科隆公司,分析纯;超纯水,美国Millipore公司Millipore型超纯水器自制。
1.3 方法 1.3.1 色谱条件色谱柱:SepaxGP-C18(2.1 mm×50 mm,1.8 μm),美国SEPAX公司;柱温:40℃;流动相:A相为0.15%甲酸-0.04%氨水-水(超声20 min后,加入0.01% 氨水),B相为0.15%甲酸-0.04%氨水-98%乙腈;梯度洗脱:0.01~0.60 min,B相48%~78%;0.60~0.90 min,B相78%~95%;0.90~0.95 min,B相95%~100%;0.95~1.50 min,B相保持100%不变;1.50~1.51 min,B相100%~48%;1.51~2.1 min,B相保持48%不变。流量:0.3 mL/min,进样量:6 μL,进样时长:2.1 min。
1.3.2 质谱条件采用多反应离子监测(MRM,multiple reaction monitoring),正离子模式扫描,ESI(电喷雾离子源,electron spray ionization),气帘气 35 psi(1 psi = 6.895 kPa),雾化气 40 psi,加热辅助气 60 psi,离子源温度 500 ℃,喷雾电压 5 500 V,去簇电压 120 V,射入电压 14 V,碰撞室射出电压 13 V。LST、d4-LST的检测离子对分别为(m/z)423.1→207.1、427.2→211.2,碰撞能量 18 V;LCA、d4-LCA的检测离子对分别为(m/z)437.1→235.2、441.2→239.2,碰撞能量 23 V。
1.3.3 溶液的配制LST、LCA标准曲线储备液及工作液配制:精密称取LST标准品10.18 mg(相当于LST 10 mg)、LCA标准品10.22 mg(相当于LCA 10 mg),分别置于两个50 mL容量瓶中,用甲醇溶解并定容至刻度,获得质量浓度均为200 μg/mL的LST、LCA标准曲线储备液,并用纯化水配制成LST为40.0,80.0,400,2 000,8 000,20 000,36 000,40 000 ng/mL,LCA为48.0,96.0,480,2 400,9 600,24 000,43 200,48 000 ng/mL的LST-LCA标准曲线系列工作液。置–35℃冰箱保存备用。LST、LCA质控储备液及工作液配制:精密称取LST标准品10.24 mg(相当于LST 10 mg)、LCA标准品10.80 mg(相当于LCA 10 mg),分别置于两个50 mL容量瓶中,用甲醇溶解并定容至刻度,获得质量浓度均为200 μg/mL的LST、LCA质控储备液,并用纯化水配制成LST为40.0,120,3 200,32 000 ng/mL,LCA为48.0,144,3 840,38 400 ng/mL的LST-LCA质控工作液。置–35℃冰箱保存备用。
内标d4-LST、d4-LCA储备液及工作液的配制:取d4-LST 1 mg(1个包装)置于10 mL容量瓶中,取d4-LCA标准品10 mg(1个包装)置于50 mL容量瓶中,分别用甲醇溶解并定容至刻度,即得质量浓度为100 μg/mL的d4-LST储备液、质量浓度为200 μg/mL的d4-LCA储备液;置–35℃冰箱保存备用。取d4-LST储备液0.2 mL,d4-LCA储备液0.125 mL,加入9.675 mL乙腈,获得质量浓度为d4-LST-2 000 ng/mL和d4-LCA-2 500 ng/mL的内标中间工作液,再用乙腈将其稀释成质量浓度为d4-LST-20 ng/mL 和d4-LCA-25 ng/mL的内标工作液。配置好的溶液置4℃冰箱保存备用。
1.3.4 样品处理取待测血浆样品50 μL,加入150 μL内标工作液(d4-LST-20 ng/mL+d4-LCA-25 ng/mL),混匀30 s,低温离心5 min(13 000 r/min,8℃),取上清液100 μL,加稀释剂1%甲酸水50 μL,混合均匀,进样6 μL。
1.3.5 专属性取6个来源的空白血浆样本、标准曲线最低管血浆样本,除空白血浆以乙腈代替内标工作液外,其余均按1.3.4项下操作考察LST和LCA的专属性。
1.3.6 标准曲线将LST-LCA标准曲线系列工作液加入空白血浆中,得LST质量浓度为2.00,4.00,20.0,100,400,1 000,1 800,2 000 ng/mL,LCA质量浓度为2.40,4.80,24.0,120,480,1 200,2 160,2 400 ng/mL的LST-LCA血样。按1.3.4项下处理后进样分析,以待测物质量浓度x为横坐标,待测物与内标的峰面积比值y为纵坐标,进行线性回归得LST、LCA的标准曲线,权重系数为1/c2。
1.3.7 定量下限以标准曲线的最低非零浓度点作为定量下限,配制浓度相当于标准曲线最低管,即LST血浆浓度为2.00 ng/mL、LCA血浆浓度为2.40 ng/mL的样品,按1.3.4项下处理,连续进样6次测定其浓度,计算其精密度与准确度。
1.3.8 基质效应以纯水为溶剂,配制LST质量浓度为3.00 ng/mL、LCA质量浓度为3.60 ng/mL的低浓度基质效应工作液与LST质量浓度为800 ng/mL、LCA质量浓度为960 ng/mL的高浓度基质效应工作液。取6个不同来源的空白血浆作为血浆基质,每一空白血浆6份(低、高浓度各3份),再取纯化水6份作为对照基质,除稀释剂1%甲酸水以相应基质效应工作液代替外,其余均按1.3.4项下处理,获得LST、LCA和内标d4-LST、d4-LCA峰面积,根据每一浓度样本2种基质中的峰面积比值计算基质效应。此外,配制脂血血浆(20%脂肪乳:空白血浆=1:9)、溶血血浆(冻融后全血:空白血浆=2:98),按以上相同方法考察脂血、溶血基质效应。
1.3.9 精密度与准确度取用质控工作液加空白血浆配制的高、中、低、定量下限4个浓度质控血浆样本,每个浓度6份,按1.3.4项下操作,测定3批,根据每批随行标准曲线,计算每个样品的实测浓度,并分析计算批内、批间精密度和准确度。根据SFDN《生物样品定量分析方法验证指导原则》,分析方法的精密度为测量值的相对标准偏差(变异系数),准确度为该方法测得值与分析物标示浓度的接近程度,表示为(测得值/真实值)×100%。
1.3.10 提取回收率制备高、中、低3个浓度质控血浆样本,每个浓度3份,按1.3.4项下操作,以其进样得到的峰面积除以空白血浆经蛋白沉淀后,直接加入相应基质效应工作液后进样得到的峰面积,计算血浆中LST、LCA及内标d4-LST、d4-LCA的提取回收率。
1.3.11 稳定性以纯化水为溶剂,将相应储备液、工作液配制成与标准曲线最高管进样浓度一致的稳定性考察工作液,分别进样3次以考察储备液、工作液短期保存稳定性(室温下保存22 h),储备液长期保存稳定性(–35℃冰冻保存117 d),工作液长期保存稳定性(–35℃冰冻保存71 d)。
制备高、低2个浓度质控血浆样本,各21份,按1.3.4项下操作,记录色谱峰面积,由当日标准曲线计算其浓度,与未放置、储存样本比较,分别考察反复冻融稳定性:–35 ℃反复冻融5次;室温放置稳定性:血浆样本室温(19.5℃)下放置8 h;上清液放置稳定性:血浆样本沉淀离心后,上清液室温放置30 h;进样室放置稳定性:待测样品于自动进样器(8℃)放置16 h后进样;重复进样稳定性:制备完成后的样品重复进样3次;长期保存稳定性:–35℃、–80℃冰冻保存71 d;全血放置稳定性:全血样本在室温条件下放置6 h。
2 结 果 2.1 专属性空白血浆按1.3.4项下操作进样,得色谱图见图1(a),其本底值均低于300 cps,LST、LCA及其内标均无响应,标准曲线最低管血浆样本按1.3.4项下操作进样后得色谱图见图1(b),LST及内标d4-LST的保留时间为1.16 min,LCA及内标d4-LCA的保留时间为1.26 min。空白血浆中在LST、LCA保留时间处出峰面积均小于标准曲线最低管血浆样本的20%,对应内标出峰位置均小于标准曲线最低管血样的1%,两组色谱图对比可知空白血浆中的内源性物质不干扰LST和LCA的测定。

|
| 图 1 UPLC-MS/MS法测定人血浆中LST、LCA及内标d4-LST、d4-LCA的典型色谱图 |
2.2 标准曲线
以待测物浓度x为横坐标,待测物与内标的峰面积比值y为纵坐标,进行线性回归得LST、LCA的标准曲线:LST:y=0.022 0x+0.005 53(r=0.999 2),LCA:y=0.012 4x+0.001 94(r=0.999 3),权重系数为1/c2(见图2)。LST在2.00~2 000 ng/mL、LCA在2.40~2 400 ng/mL范围标准曲线线性良好。

|
| 图 2 UPLC-MS/MS法测定人血浆中LST、LCA浓度的标准曲线 |
2.3 定量下限
标准曲线最低管浓度即定量下限,LST的血浆浓度为2.00 ng/mL,LCA血浆浓度为2.40 ng/mL。定量下限的考察结果中,LST的准确度为105.8%±0.1%,精密度(RSD)为3.8%,LCA的准确度为105.2%±0.1%,精密度(RSD)为5.4%。
2.4 基质效应通过内标校准,血浆基质LST的低、高浓度基质效应分别为102.8%±3.8%、101.8%±0.9%,其RSD为3.7%、0.8%,LCA的低、高浓度基质效应分别为101.5%±2.7%、101.7%±0.4%,其RSD为2.7%、0.4%;溶血、脂血基质LST的低、高浓度基质效应分别为102.5%±0.4%、101.8%±0.3%,其RSD为0.4%、0.3%,LCA的低、高浓度基质效应分别为102.4%±0.1%、100.6%±0.1%,其RSD均为0.1%(见表1)。
2.5 精密度与准确度如表1所示,LST每一浓度水平样品的批内精密度RSD在1.6%~3.5%之间;批间精密度RSD在3.2%~5.3%之间;批内准确度在94.2%~105.2%之间,批间准确度在93.3%~106.6%之间。LCA每一浓度水平样品的批内精密度RSD在1.3%~4.4%之间;批间精密度RSD在2.5%~4.8%之间;批内准确度在91.9%~101.0%之间,批间准确度在93.4%~99.5%之间。
2.6 提取回收率低、中、高3个浓度的质控样品提取回收率,结果见表1,LST、LCA的提取回收率平均值分别为109.9%与97.55%。
| 物质 | 理论浓度/
(ng·mL–1) |
批内准确度
(n=6)/% |
批间准确度
(n=18)/% |
批内RSD
(n=6)/% |
批间RSD
(n=18)/% |
提取回收率
(n=3)/% |
基质效应RSD/% | |
| 血浆
(n=6) |
脂血、溶血
(n=2) |
|||||||
| LST | 1 600 | 94.2 | 93.3 | 3.5 | 3.2 | 106.8 | 0.8 | 0.3 |
| 160.0 | 105.2 | 100.4 | 1.6 | 4.1 | 104.3 | – | – | |
| 6.00 | 101.9 | 100.0 | 3.1 | 3.8 | 118.5 | 3.7 | 0.4 | |
| 2.00 | 102.0 | 106.6 | 2.8 | 5.3 | – | – | – | |
| LCA | 1 920 | 91.9 | 93.4 | 4.3 | 3.0 | 103.0 | 0.4 | 0.1 |
| 192.0 | 100.9 | 99.5 | 1.3 | 2.5 | 90.2 | – | – | |
| 7.20 | 101.0 | 98.7 | 2.3 | 3.1 | 99.5 | 2.7 | 0.1 | |
| 2.40 | 98.3 | 98.2 | 4.4 | 4.8 | – | – | – | |
2.7 稳定性
储备液、工作液的平均稳定性及血浆样本RSD均小于15%,符合相关要求,如表2、表3所示。
| 物质 | 理论浓度/(ng·mL–1) | 储备液 | 工作液 | |||
| 短期(22 h)稳定性/% | 长期(–35℃,117 d)稳定性/% | 短期(22 h)稳定性/% | 长期(–35℃,71 d)稳定性/% | |||
| LST | 2 000 | -1.11 | -3.43 | -0.02 | 0.37 | |
| LCA | 2 400 | 1.67 | -2.65 | -0.91 | 2.46 | |
| 物质 | 理论浓度/(ng·mL–1) | RSD/% | |||||||
| 反复冻融 | 室温放置 | 上清液放置 | 进样室放置 | 重复进样 | 长期保存71 d | 全血放置 | |||
| –35℃ | –80℃ | ||||||||
| LST | 1 600 | 2.1 | 1.7 | 2.3 | 2.4 | 1.5 | 1.0 | 1.0 | 4.8 |
| 6.00 | 1.8 | 3.7 | 3.7 | 3.5 | 7.5 | 1.9 | 1.8 | 6.0 | |
| LCA | 1 920 | 1.6 | 1.3 | 1.8 | 1.2 | 1.0 | 2.5 | 1.5 | 4.3 |
| 7.20 | 3.9 | 5.2 | 5.0 | 1.6 | 12.0 | 0.4 | 3.0 | 3.4 | |
3 应 用
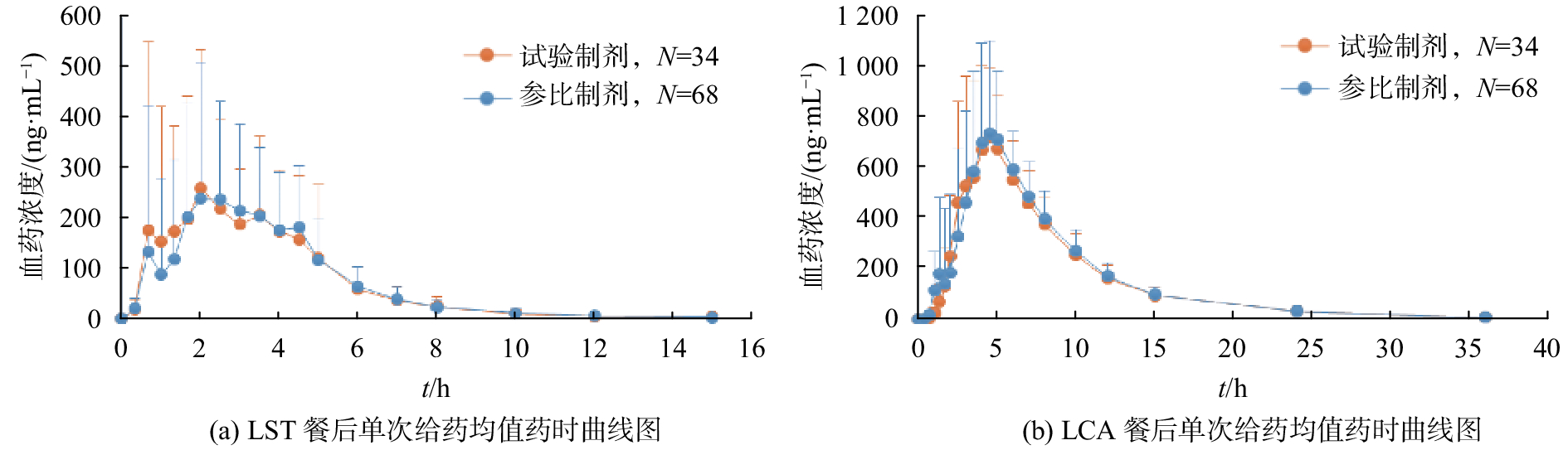
本文建立的方法已用于34例健康受试者在3个周期里餐后单次口服氯沙坦钾片0.1 g的样品测定,均值药时曲线见图3。由图可知,试验制剂与参比制剂餐后单次给药LST、LCA的药时曲线变化趋势一致。代谢物LCA的达峰时间比药物LST晚了约3 h,LST在服药15 h后基本消除。此外,LST与LCA在吸收和分布向的标准偏差均较大,符合氯沙坦钾作为高变异药物的特点,与文献[9-17]报道一致。
|
| 图 3 UPLC-MS/MS法测定人血浆中LST、LCA浓度的均值药时曲线图 |
4 讨 论
在已有文献报道的氯沙坦血药浓度检测方法中,Prasaja B等[18]采用了沉淀蛋白法,但其分析时间较长为3.5 min,血浆用量250 μL,氯沙坦线性范围2~400 ng/mL,氯沙坦羧酸线性范围1.85~370 ng/mL;王嫣然等[12]的研究分析时长2.5 min,但其前处理方法为相对麻烦的液液萃取法且血浆用量高达500 μL;方翼等[17]采用沉淀蛋白法,分析时长3 min,血浆用量50 μL,但其检测的是健康受试者口服50 mg氯沙坦钾片的血浆浓度。本试验在以上研究方法的基础上加以改进,以乙腈沉淀蛋白后甲酸水溶液稀释进样,对稀释剂甲酸水的浓度进行了考察,配制比例为0.5%、0.75%、1%以及2%的甲酸水,结果显示甲酸的浓度对峰宽及灵敏度有一定影响,当1%甲酸水作稀释剂时峰形最优、响应最高。试验采用梯度洗脱,待样本出峰后用98%乙腈冲洗色谱柱后再平衡进样,每个样本分析时间也仅需2.1 min,使基质效应降到最低,保证了样本分析的重现性及稳定性。
通常非极性和弱极性的化合物易获得良好的峰形,而带有-COOH、-NH2、-NHR、-NR2等极性基团的化合物则比较容易产生拖尾。由于氯沙坦及其代谢物氯沙坦羧酸的结构中均有含氮五元环、羟基和羧基等极性结构,本试验在流动相中加入了适量的甲酸以改善峰形,对甲酸的浓度以及是否加入氨进行了考察。结果显示,当流动相中仅含0.05%甲酸时,色谱峰易分叉,含0.15%甲酸时峰形改善,但在梯度冲洗有系统峰干扰测定,且LCA峰仍有拖尾现象,再加入0.04%氨后峰形达到最优,且通过调整梯度无系统峰干扰。本试验初期(夏天)流动相B相使用纯乙腈,依次加入0.15%甲酸和0.04%氨时乙腈未出现白色结晶,在12月份测定样本时发现B相有白色结晶析出,经分析甲酸铵在纯乙腈中溶解性低,冬天室温降低时容易析出,在纯乙腈中加入2%纯水(甲酸铵的良溶剂)即解决溶解性问题。
5 结束语本研究采用同位素标记药物为内标,建立了UPLC-MS/MS联用技术,沉淀蛋白法同时测定人血浆中氯沙坦及其代谢物氯沙坦羧酸的血药浓度。该方法血浆用量少(仅需50 μL),运行时间短(仅为2.1 min,含冲柱和平衡时间),线性范围广(LST:2.00~2 000 ng/mL,LCA:2.40~2 400 ng/mL),重现性好,适用于高通量的样本分析工作,已成功应用于氯沙坦钾片(0.1 g)在健康志愿者的生物等效性研究。
| [1] |
CHEUNG T T, CHEUNG B M. Managing blood pressure control in Asian patients: safety and efficacy of losartan[J].
Clinical Interventions in Aging, 2014, 2014(default): 443.
|
| [2] |
LO M W, MICHAEL R. Pharmacokinetics of losartan, an angiotensin II receptor antagonist, and its active metabolite EXP3174 in humans[J].
Clinical Pharmacology & Therapeutics, 1995, 58(6): 641-649.
|
| [3] |
WANG Y H, PAN P P, DAI D P, et al. Effect of 36 CYP2C9 variants found in the Chinese population on losartan metabolism in vitro[J].
Xenobiotica; the fate of foreign compounds in biological systems, 2014, 44(3): 270.
DOI:10.3109/00498254.2013.820007 |
| [4] |
YASAR U, FORSLUNDBERGENGREN C, TYBRING G, et al. Pharmacokinetics of losartan and its metabolite E-3174 in relation to the CYP2C9 genotype[J].
Clinical Pharmacology & Therapeutics, 2002, 71(1): 89-98.
|
| [5] |
田自有,陈赛贞,徐利君,蒋玲燕,张斌,郑斌斌. RP-HPLC法测定人血浆中氯沙坦钾、厄贝沙坦和格列齐特浓度[J].
中国临床药学杂志, 2013, 22(04): 230-233.
|
| [6] |
韦阳, 黄慧芳, 邵庆翔,等. 国产氯沙坦钾片的生物等效性研究[J].
中国临床药理学杂志, 2000, 16(2): 106-110.
|
| [7] |
金杰. 健康志愿者氯沙坦钾片的生物等效性研究[J].
中国医药指南, 2013(2): 3-5.
|
| [8] |
杨平, 王艳娇, 李琳,等. 氯沙坦钾胶囊与片在健康人体的生物等效性[J].
中国临床药理学杂志, 2006, 22(6): 436-439.
|
| [9] |
陈露露, 谭志荣, 阳国平,等. 氯沙坦钾片的生物等效性及CYP2C9*3基因多态性对氯沙坦药代动力学的影响[J].
中国临床药理学与治疗学, 2015, 20(2): 175-181.
|
| [10] |
苑菲, 许剑安, 汪红,等. LC-MS/MS法测定氯沙坦及其代谢物的血浆浓度及氯沙坦钾片生物等效性评价[J].
中国临床药学杂志, 2013(1): 13-18.
|
| [11] |
商丹丹,邸欣,王鑫,张慧霞,封美慧,刘有平. 液相色谱-串联质谱法同时测定人血浆中氯沙坦及其活性代谢物氯沙坦酸的浓度[J].
中国新药与临床杂志, 2013, 32(12): 975-980.
|
| [12] |
王嫣然,王彩平,谢荟茹,王凌,蒋学华. HPLC-MS/MS同时测定人体血浆中氯沙坦钾与其代谢物氯沙坦羧酸(E-3174)的浓度及其药动学应用[J].
中国药学杂志, 2014, 49(12): 1056-1061.
|
| [13] |
高荧,乔亚楠,陆宇婷,宋敏,杭太俊,马鹏程. 液相色谱-串联质谱法同时测定人血浆中氯沙坦、5-羧酸氯沙坦和氢氯噻嗪的浓度及药动学[J].
中国新药与临床杂志, 2014, 33(12): 884-889.
|
| [14] |
SHAH H J, KUNDLIK M L, PATEL N K, et al. Rapid determination of losartan and losartan acid in human plasma by multiplexed LC-MS/MS[J].
Journal of Separation Science, 2009, 32(20): 3388-3394.
DOI:10.1002/jssc.v32:20 |
| [15] |
黄明,张全英,宗顺麟. LC-MS/MS快速测定人血浆中氯沙坦浓度及其生物等效性研究[J].
实用药物与临床, 2017, 20(04): 443-446.
|
| [16] |
马萍, 李鹏飞, 童卫杭,等. 氯沙坦钾片在健康人体的生物等效性[J].
中国临床药理学杂志, 2012, 28(3): 179-182.
|
| [17] |
方翼, 关鑫, 顾景凯,等. 国产氯沙坦钾片在中国健康志愿者的药动学及生物等效性研究[J].
中国药学杂志, 2010, 45(20): 1572-1577.
|
| [18] |
PRASAJA B, SASONGKO L, HARAHAP Y, et al. Simultaneous quantification of losartan and active metabolite in human plasma by liquid chromatography-tandem mass spectrometry using irbesartan as internal standard[J].
Journal of Pharmaceutical & Biomedical Analysis, 2009, 49(3): 862.
|
| [19] |
李三妮, 张古英, 韩华. UPLC-MS/MS法同时测定人血浆中氯沙坦、氨氯地平和辛伐他汀的浓度[J].
药学与临床研究, 2015(6): 539-542.
|
| [20] |
邹晓华,王双虎,胡国新,周云芳. UPLC-MS/MS快速测定大鼠血浆中的氯沙坦及其代谢产物[J].
中国现代应用药学, 2014, 31(06): 727-731.
|
 2018, Vol. 44
2018, Vol. 44