文章信息
- 杨敬坡, 王文军, 郭延凯, 陈晓轩, 都泽铭
- YANG Jingpo, WANG Wenjun, GUO Yankai, CHEN Xiaoxuan, DU Zeming
- 一种利用QuEChERS-GC/MS测定苹果种植土壤中5种常见菊酯类农药的方法研究
- QuEChERS-GC/MS method for determination of 5 pyrethroid pesticide residues in planting soil of apple
- 中国测试, 2018, 44(11): 71-76
- CHINA MEASUREMENT & TEST, 2018, 44(11): 71-76
- http://dx.doi.org/10.11857/j.issn.1674-5124.2018.11.013
2. 河北省污染防治生物技术实验室,河北 石家庄 050018;
3. 保定学院汽车与电子工程学院,河北 保定 071051
2. Pollution Prevention Biotechnology Laboratory of Hebei Province, Shijiazhuang 050018, China;
3. College of Automobile and Electronic Engineering, Baoding College, Baoding 071051, China
菊酯类农药是由天然除虫菊酯为基础发展起来的一类杀虫剂,属于广谱、低毒、高效类的杀虫剂,是目前农业用量较大的一类农药,现在已广泛应用于防治农林、卫生等病虫害。苹果的栽培过程中,主要通过施用有机磷和菊酯类农药防治虫害,据初步估计,施入果园的菊酯类农药有80%~90%最终都进入土壤,而使果园土壤环境的潜在污染日趋严重[1-6]。土壤随着雨水、微生物降解等方式,有一定的净化作用,但如果进入土壤中的菊酯类农药在数量和速度上超过果园土壤的净化能力,终将导致果园土壤中农药过量而影响环境。随着人们健康意识、环保意识的增强,环境问题越来越受到广泛关注,且菊酯类农药在人体有一定的蓄积性,部分品种对人体有致畸、致突变的影响[7-9],因此,准确测定果园土壤中菊酯类农药残留量对于指导果园种植中农药的使用具有现实意义。
目前,用于果园土壤中菊酯类农药检测的方法主要有气相色谱法、液相色谱法、气相色谱-质谱联用法、液相色谱-质谱联用法[10-13]等。气相色谱法配备ECD检测器,检出限低,但由于土壤基质较为复杂,假阳性检出率较高;液相色谱法和液相色谱-质谱联用法,检出限偏高,不适用于土壤中微量农残的检测;气相色谱-质谱联用法不仅检出限低,对于基质较为复杂的土壤,能够准确地进行定性检测。土壤样品的前处理方法主要有固相萃取法、加速溶剂萃取法等,这些方法取代了传统的耗费大量时间和溶剂的普通提取方法;但是通常需要较为繁琐的提取步骤,且溶剂使用量较大,易造成实验室和环境污染。最初应用于农残检测的QuEChERS方法,是一种快速、简单、高效的样品前处理方法,但应用于土壤样品农残检测的报道不多。本文实验建立一种利用QuEChERS法进行果园土壤中菊酯类农药提取,气相色谱-质谱联用仪定性定量检测农残的方法。
1 方法与材料 1.1 仪器和试剂 1.1.1 仪 器气相色谱仪:岛津GC-2010plus型(日本岛津公司);质谱仪:QP2010ultra系统(日本岛津公司);电子天平:XS205型,0.01 mg(瑞士梅特勒公司);数控超声波清洗机:SK3300LH型(广州沪瑞明仪器有限公司);色谱柱:HP-5MS质谱专用毛细管色谱柱(安捷伦科技有限公司);高速冷冻离心机:H2100R型(湘仪离心机公司);固相萃取柱:SUPELCO C18 500 mg/6 mL(美国SUPELCO公司);纯水仪:Milli-Q(密理博科技有限公司);涡旋混合器:T25,3 000~18 000 r/min(广州IKA公司);回旋振荡器:HY-5A型(金坛市江南仪器厂)。
1.1.2 标准物质、试剂甲氰菊酯、联苯菊酯、高效氯氟氰菊酯、氯菊酯、氰戊菊酯标准溶液:浓度均为100 μg/mL,农业部环境保护科学研究所;QuEChERS吸附剂:安谱QuEChERS(硫酸镁、PSA和C18)净化管和QuEChERS(硫酸镁和乙酸钠)萃取包;甲醇、丙酮、乙腈、二氯甲烷、环己烷:色谱纯(德国默克公司);冰乙酸:分析纯(国药集团上海试剂有限公司)。
1.2 仪器参数设置 1.2.1 气相色谱参数进样口温度:260 ℃;进样方式:不分流;载气:氦气(纯度99.999%以上);碰撞气:氩气(纯度99.999%以上);柱流量:1.8 mL/min;尾吹:75 mL/min;进样量:1 μL;升温程序:40 ℃保持1 min,40 ℃升温至130 ℃,升温速率23 ℃/min,130 ℃升温至280 ℃,升温速率6 ℃/min。
1.2.2 MS参数离子源:ESI离子源;扫描方式:多反应监测(MRM);电子能量:75 eV;接口温度:270 ℃;离子源温度:240 ℃;溶剂延迟时间:2.5 min。
1.3 溶液配制标准储备溶液:准确移取100 µg/mL的甲氰菊酯、联苯菊酯、高效氯氟氰菊酯、氯菊酯、氰戊菊酯标准溶液各1 mL置于同一个10 mL量瓶中,加适量丙酮溶解,再用丙酮定容,摇匀,即得(甲氰菊酯、联苯菊酯、高效氯氟氰菊酯、氯菊酯、氰戊菊酯的浓度均为10 µg/mL)。
标准曲线溶液:分别取标准储备溶液适量,加丙酮稀释制成质量浓度依次为0.1,0.5,1.0,5.0,10.0,50.0 µg/mL的标准曲线溶液,加丙酮定容至刻度,摇匀,即得。
样品溶液:取有代表性的苹果种植土壤约200 g,粉碎机粉碎(或研细),精密称取约10 g土壤样品,置于25 mL塑料离心管中,加9 mL乙腈、1 mL冰乙酸,超声提取10 min,再涡旋混合约1 min;加入硫酸镁、乙酰乙酸提取包,涡旋约1 min,振荡器振荡20 min,然后离心5 min;取离心后的上层清液约5 mL置于装有分散固相萃取剂的15 mL离心管中,涡旋约2 min,然后离心5 min;取离心后的上层清液约3 mL至刻度试管中,45 ℃氮吹至近干,加1 mL丙酮溶解残渣,涡旋1 min,0.45 µm滤膜过滤,即得。
2 结果与讨论 2.1 农药前处理方法的选择QuEChERS提取方法是2002年开发出来的一种快速、简单、廉价、高效、耐用、安全的农残提取的前处理方法。土壤样品基质较为复杂,其中含有大量有机物和无机物等共存杂质,因此选择合适的前处理方法是技术难点。目前,土壤中农药残留的提取方法主要有固相萃取法、GPC加浓缩法和快速溶剂萃取法。GPC加浓缩法和快速溶剂萃取法,耗用溶剂较大,仪器成本较高,不利于方法推广应用;实验比较QuEChERS提取方法和固相萃取方法对于加标回收的影响。结果表明,采用QuEChERS提取方法得到的5种菊酯类农药的回收率更优,比较结果见表1。
| 组分名称 | 固相萃取方法
回收率/% |
QuEChERS提取方法
回收率/% |
| 甲氰菊酯 | 82.9 | 90.5 |
| 联苯菊酯 | 86.5 | 91.3 |
| 高效氯氟氰菊酯 | 79.9 | 88.4 |
| 氯菊酯 | 82.8 | 91.9 |
| 氰戊菊酯 | 80.2 | 87.5 |
2.2 程序升温条件的优化
程序升温参数的设置是影响5种菊酯类农药分离和保障色谱峰型的重要因素。实验选择等温条件,设置柱温为200 ℃,5种菊酯类农药在HP-5MS色谱柱上的保留顺序依次为:联苯菊酯、甲氰菊酯、高效氯氟氰菊酯、氯菊酯和氰戊菊酯。为使色谱峰峰型良好,选择冷柱头进样方式,保持其他条件不变,初始温度分别设置40 ℃、50 ℃、60 ℃。实验证明,选择40 ℃时,5种菊酯类农药峰型最好,60 ℃时,色谱峰展宽,峰型最差;升温速度先选择高速率23 ℃/min至130 ℃,再以低升温速率6 ℃/min升温至280 ℃,实现了5种菊酯类农药的良好分离。
2.3 萃取剂的选择土壤是成分很复杂的混合物,一般情况下主要含有二氧化硅、各种有机物、金属氧化物等化合物和一部分金属单质。5种菊酯类农药在弱极性溶剂丙酮和乙腈中易溶解,实验比较了丙酮、乙腈、丙酮-冰乙酸和乙腈-冰乙酸等溶剂的提取效果。实验证明:采用丙酮和乙腈作为提取剂时,5种菊酯类农残回收率偏低,且基质干扰较大;采用丙酮-冰乙酸作为提取剂时,5种菊酯类农残回收率在80%~120%之间,但基质干扰较大;采用乙腈-冰乙酸作为提取剂时,5种菊酯类农残回收率在80%~120%之间,且基质干扰最小。故选择乙腈-冰乙酸作为萃取剂。
2.4 空白试剂影响研究实验按照样品提取步骤,分别配制试剂空白、试剂加标,按1.2实验条件进样分析。过程如下:取25 mL塑料离心管,加9 mL乙腈、1 mL冰乙酸,超声提取10 min,再涡旋混合约1 min;在加入硫酸镁、乙酰乙酸提取包,涡旋约1 min,振荡器振荡20 min,然后离心5 min;取离心后的上层清液约5 mL置于装有分散固相萃取剂的15 mL离心管中,涡旋约2 min,然后离心5 min;取离心后的上层清液约3 mL至刻度试管中,45 ℃氮吹至近干,加1 mL丙酮溶解残渣,涡旋1 min,0.45 µm滤膜过滤,得试剂空白溶液;同法在25 mL塑料离心管中先行加入一定量标准溶液,后续按上述配制方式进行,得试剂加标溶液。实验结果表明,试剂空白无干扰,试剂加标回收率在86.3%~95.4%之间。
2.5 质谱条件的优化取甲氰菊酯、联苯菊酯、高效氯氟氰菊酯、氯菊酯、氰戊菊酯标准溶液,分别配制质量浓度约为10 µg/mL的单标溶液,加丙酮稀释至刻度,摇匀。5种菊酯类农药分别进行Q1Scan(全扫描模式),得到甲氰菊酯、联苯菊酯、高效氯氟氰菊酯、氯菊酯、氰戊菊酯的总离子流图、保留时间和母离子;然后将各个农药对应的母离子进行production scan (产物离子扫描模式),得到5种菊酯类农药的定量离子对和定性离子对;分别对5种菊酯类农药的定量离子和定性离子,进行碰撞时间、碰撞电压等的优化。优化完毕后,建立5种菊酯类农药的MRM方法(多反应监测)。典型谱图如图1所示。
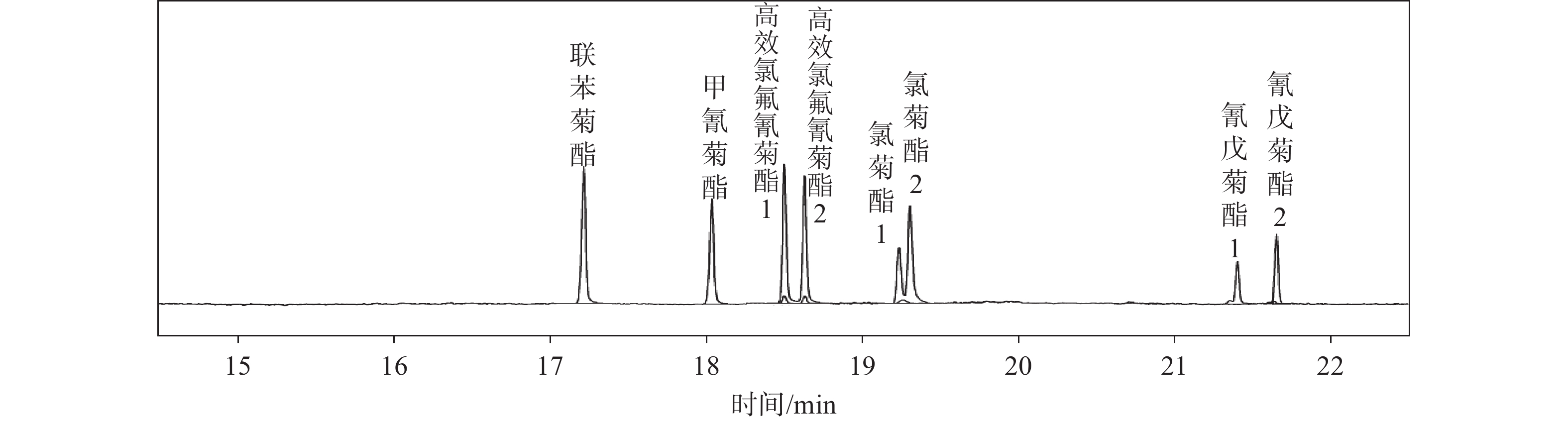
|
| 图 1 5种农药标准总离子流图 |
2.6 线性方程及检出限
分别取1.3溶液配制项下标准储备溶液适量,加丙酮稀释制成质量浓度依次为0.1,0.5,1.0,5.0,10.0,50.0 µg/mL的标准曲线溶液,加丙酮定容至刻度,摇匀;待GC-MS仪器稳定后,分别进样上述6个标准溶液,得到5种菊酯类农药不同浓度点的峰面积,再以峰面积为纵坐标、浓度为横坐标绘制标准曲线。依据GB/T32465-2015《化学分析方法验证确认和内部质量控制要求》,以3倍信噪比计算检出限,10倍信噪比计算定量限。5种菊酯类农药线性范围、曲线方程、相关系数、检出限及定量限见表2。
| 农药名称 | 线性范围/(μg·mL–1) | 线性方程 | 相关系数 | 检出限/(mg·kg–1) | 定量限/(mg·kg–1) |
| 甲氰菊酯 | 0.1~50.0 | Y=29.318X-0.172 | 0.997 8 | 0.01 | 0.04 |
| 联苯菊酯 | 0.1~50.0 | Y=13.284X+2.936 | 0.998 2 | 0.008 | 0.03 |
| 高效氯氟氰菊酯 | 0.1~50.0 | Y=12.168X-13.629 | 0.996 9 | 0.008 | 0.03 |
| 氯菊酯 | 0.1~50.0 | Y=10.284X-0.937 | 0.997 1 | 0.01 | 0.04 |
| 氰戊菊酯 | 0.1~50.0 | Y=11.118X+4.129 | 0.998 4 | 0.02 | 0.06 |
2.7 方法回收率实验
取有代表性的苹果种植土壤约200 g,粉碎机粉碎(或研细),精密称取约10 g土壤样品,置于25 mL塑料离心管中,分别取1.3溶液配制项下标准储备溶液适量,加到样品中(加标后浓度依次为:0.1,1.0,10.0 µg/mL),后续按照1.3样品溶液配制方法进行前处理。待仪器稳定后,分别进样上述3个浓度的样品加标溶液,计算加标回收率。结果表明,5种菊酯类农药3个浓度点的加标回收率在80.6%~106.7%之间,结果见表3。
| 农药名称 | 不同加标浓度点回收率 | ||
| 0.1 µg/mL | 1.0 µg/mL | 10.0 µg/mL | |
| 甲氰菊酯 | 80.6% | 90.5% | 93.4% |
| 联苯菊酯 | 106.7% | 91.3% | 90.7% |
| 高效氯氟氰菊酯 | 102.4% | 88.4% | 94.6% |
| 氯菊酯 | 84.6% | 91.9% | 92.5% |
| 氰戊菊酯 | 92.5% | 87.5% | 89.0% |
2.8 方法重复性试验
取有代表性的苹果种植土壤约200 g,粉碎机粉碎(或研细),精密称取约10 g土壤样品,置于25 mL塑料离心管中,分别取1.3溶液配制项下标准储备溶液适量,加到样品中(加标后浓度为0.5 µg/mL),后续按照1.3样品溶液配制方法进行前处理,同法配制6份样品加标溶液。待仪器稳定后,6份样品溶液各进样1针,计算6次重复性的相对标准偏差RSD;取6份样品中任意一份,连续进样6次计算精密度的相对标准偏差RSD。结果表明,5种菊酯类农药重复性RSD结果在3.5%~4.6%之间,精密度RSD结果在1.8%~2.8%之间,结果见表4和5。
| 农药名称 | 测定值/(μg·mL–1) | 平均值/(μg·mL–1) | RSD/% | |||||
| 甲氰菊酯 | 0.503 1 | 0.476 8 | 0.453 9 | 0.481 1 | 0.501 2 | 0.471 8 | 0.481 3 | 3.9 |
| 联苯菊酯 | 0.431 4 | 0.481 9 | 0.432 2 | 0.451 7 | 0.469 2 | 0.442 8 | 0.451 5 | 4.6 |
| 高效氯氟氰菊酯 | 0.439 9 | 0.417 9 | 0.476 2 | 0.441 7 | 0.444 4 | 0.437 7 | 0.443 0 | 4.3 |
| 氯菊酯 | 0.471 1 | 0.453 2 | 0.502 1 | 0.481 6 | 0.491 8 | 0.488 7 | 0.481 4 | 3.6 |
| 氰戊菊酯 | 0.511 2 | 0.463 6 | 0.481 2 | 0.490 2 | 0.502 8 | 0.493 3 | 0.490 4 | 3.5 |
| 农药名称 | 测定值/(μg·mL–1) | 平均值/(μg·mL–1) | RSD/% | |||||
| 甲氰菊酯 | 0.457 1 | 0.434 1 | 0.461 5 | 0.442 3 | 0.432 9 | 0.447 5 | 0.445 9 | 2.7 |
| 联苯菊酯 | 0.511 4 | 0.478 3 | 0.504 2 | 0.492 6 | 0.507 2 | 0.515 2 | 0.501 5 | 2.8 |
| 高效氯氟氰菊酯 | 0.487 6 | 0.465 2 | 0.472 9 | 0.467 8 | 0.471 6 | 0.480 6 | 0.474 3 | 1.8 |
| 氯菊酯 | 0.442 1 | 0.432 7 | 0.421 9 | 0.443 3 | 0.428 1 | 0.446 9 | 0.435 8 | 2.3 |
| 氰戊菊酯 | 0.449 3 | 0.431 2 | 0.452 6 | 0.455 2 | 0.439 5 | 0.442 3 | 0.445 0 | 2.1 |
2.9 同类方法比较研究
实验选择用此方法与现行国家标准GB/T 14550-2003 《土壤中六六六和滴滴涕测定的气相色谱法》与农业部NY/T 761-2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》进行比较。过程如下:分别在空白土壤中加入一定量标准溶液,采用本文实验方法、GB/T14550-2003方法以及NY/T 761-2008进行前处理,按1.2实验条件进样分析。结果表明,采用本实验方法前处理过程简单,检测结果准确度较高,比较结果见表6。
| 组分名称 | 本实验方法
回收率/% |
GB/T 14550-2003
方法回收率/% |
NY/T 761-2008
方法回收率/% |
| 甲氰菊酯 | 91.2 | 84.6 | 79.5 |
| 联苯菊酯 | 90.4 | 82.9 | 84.4 |
| 高效氯氟氰菊酯 | 87.5 | 80.9 | 78.6 |
| 氯菊酯 | 92.5 | 88.4 | 74.7 |
| 氰戊菊酯 | 88.1 | 87.2 | 72.9 |
3 结束语
实验建立一种利用QuEChERS提取方法对苹果种植土壤进行5种菊酯类农药的提取,采用气相色谱-质谱法进行定性定量分析。首先对前处理方法进行比较,证明采用QuEChERS提取方法得到农药的回收率更好;优化了气相色谱程序升温条件;优化了萃取溶剂;对质谱检测条件进行了优化,建立5种菊酯类农药的MRM(多反应监测)方法;考察了方法的线性曲线,相关系数r2均不低于0.995;检出限在0.008~0.02 mg/kg之间,定量限在0.03~0.06 mg/kg之间;3个浓度点(0.1,1.0,10.0 µg/mL)加标回收率在80.6%~106.7%之间;方法重复性RSD在3.5%~4.6%之间,精密度RSD在1.8%~2.8%之间。结果表明,本方法具有前处理简单、快速,检测准确度较高,灵敏度高等优点,可以用于苹果种植土壤中菊酯类农药的检测,为合理化使用各种菊酯类农药以及种植土壤中菊酯类农药残留的分析检测提供技术依据。
| [1] |
沈佳怡, 李燕, 戴维益, 等. 高效氯氟氰菊酯对土壤酶活性的影响[J].
广州化工, 2017, 45(15): 85-87.
DOI:10.3969/j.issn.1001-9677.2017.15.030 |
| [2] |
梁茹晶, 宋雪英, 宋晗, 等. 氟氯氰菊酯、溴氰菊酯和联苯菊酯对赤子爱胜蚓的急性毒性[J].
沈阳药科大学学报, 2016, 33(11): 901-907.
|
| [3] |
于玲, 董丽丽. 分散固相萃取-超声辅助分散液液微萃取/高效液相色谱法测定土壤中溴氰菊酯残留[J].
分析科学学报, 2016, 32(2): 218-222.
|
| [4] |
王世英, 黄日林, 李梓豪, 等. 联苯菊酯在甘蓝及土壤中的消解动态[J].
华南农业大学学报, 2016, 37(3): 82-85.
|
| [5] |
李劭彤, 李朝阳, 李巧玲, 等. 甲氰菊酯微生物降解的研究进展[J].
江苏农业科学, 2015, 43(11): 17-20.
|
| [6] |
吴俊, 郑翔, 让蔚清. QuEchERS法在食品农药残留检测中的应用前景[J].
实用预防医学, 2010, 17(3): 619-621.
DOI:10.3969/j.issn.1006-3110.2010.03.092 |
| [7] |
陈姣姣, 张静, 吴思卓, 等. 气相色谱法测定苹果和土壤中的高效氯氟氰菊酯[J].
色谱, 2016, 34(10): 1005-1010.
|
| [8] |
王璞, 何明远, 刘勇, 等. 4种拟除虫菊酯类农药在苎麻与土壤中的残留消解动态及最终残留研究[J].
湖南农业科学, 2013, 43(3): 85-89.
DOI:10.3969/j.issn.1006-060X.2013.03.026 |
| [9] |
刘丽, 张琦, 王海雁, 等. 串联双柱固相萃取-气相色谱-串联质谱法检测茶叶中拟除虫菊酯[J].
色谱, 2017, 35(8): 860-866.
|
| [10] |
秦伟瀚, 阳勇, 师萱, 等. 基质分散固相萃取法同时检测13种不同产地昆明山海棠中有机磷和拟除虫菊酯类农药残留[J].
中国医院药学杂志, 2017, 37(7): 613-616.
|
| [11] |
胡西洲, 程运斌, 胡定金. QuEchERS法测定蔬菜中有机磷类农药多残留分析[J].
中国测试技术, 2006, 32(3): 132-134.
|
| [12] |
张爱娟, 梁林, 翟淑华, 等. 超高效液相色谱串联质谱法检测辣椒及土壤中啶氧菌酯的残留[J].
农药科学与管理, 2016(10): 40-43.
DOI:10.3969/j.issn.1002-5480.2016.10.010 |
| [13] |
江泽军, 张鹏, 李永飞, 等. 分散固相萃取-高效液相色谱-串联质谱法测定水稻和土壤中的福美双与甲霜灵残留[J].
农药学学报, 2015, 17(3): 313-320.
DOI:10.3969/j.issn.1008-7303.2015.03.10 |
 2018, Vol. 44
2018, Vol. 44